微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 往HI溶液中滴加淀粉溶液无任何现象,但加入某物质后溶液立即变蓝,该物质可能是
①氯水
②Na2SO3溶液
③KNO3溶液
④FeCl3溶液
⑤Na2S溶液
A.①②③④⑤
B.①③④
C.①④
D.①③
参考答案:B
本题解析:
本题难度:一般
2、填空题 根据要求填空。
(1)下列物质中,属于电解质的是?,属于非电解质的是?。(填序号)
①碳酸氢钠?②CO2?③乙醇?④铁
(2)饮用水中的NO3-对人类健康会产生危害,为了降低饮用水中NO3-的浓度,可以在碱性条件下用铝粉将NO3-还原为N2,其化学方程式为如下:
10 Al + 6 NaNO3 + 4 NaOH +18 H2O =" 10" NaAl(OH)4 + 3 N2↑
请用“单线桥法”表示上述反应中电子转移的方向和数目。
(3)已知氨气与氯气在常温条件下发生如下反应:8 NH3+3 Cl2= 6 NH4Cl +N2,该反应中还原剂与氧化剂的物质的量之比为??。
(4)今有K2SO4和Al2(SO4)3混合溶液,已知其中c(K+)=" 0.2" mol·L-1,c(SO42-)= 0.7mol·L-1。则溶液中c(Al3+)=?mol·L-1。
参考答案:(1)①;②③
(2)
(3)2:3
(4)0.4 mol/L
本题解析:(1)电解质是在水溶液中或熔化状态下能导电的化合物,而非电解质是在水溶液中和熔化状态下都不能导电的化合物。①碳酸氢钠 是盐,属于电解质;②CO2是非电解质;③乙醇是非电解质?④铁是单质,既不是电解质,也不是非电解质。(2)氧化剂得到电子,化合价降低;还原剂失去电子,化合价升高。在氧化还原反应中电子转移数目相等,即化合价升降总数相等。“单线桥法”表示上述反应中电子转移的方向和数目
(2)
(3)在反应8 NH3+3Cl2=6 NH4Cl+N2中,还原剂是NH3,氧化剂是Cl2。在8mol的NH3中有2mol的作还原剂。该反应中还原剂与氧化剂的物质的量之比为 2:3。(4)根据电荷守恒可得3c(Al3+)+ c(K+)=2c(SO42-); 3c(Al3+)=2×0.7- 0.2-? =1.2.。所以c(Al3+)=0.4mol/L。
本题难度:简单
3、填空题 (10分)A、B、C、D、E五种可溶性化合物,分别由阳离子Fe3+、Ba2+、Al3+、Na+、Ag+和阴离子NO3-、OH-、SO42-、Cl-、CO32-中的各一种组成(离子不重复)。现做如下实验:
①A和E的溶液显碱性,0.1mol·L-1A溶液的pH小于13;
②在B的溶液中逐滴加入氨水有白色沉淀生成,继续加氨水至过量,沉淀消失;
③在C的溶液中加入铁粉,溶液的质量增加;
④在D的溶液中加入过量的Ba(OH)2溶液,没有沉淀。
请回答下列问题:
(1)根据以上事实推断A—E的化学式:
A?;B?;C?;D?;E?。
(2)请用离子方程式表示A溶液显碱性的原因?。
(3)写出③、④的离子方程式:③?;④?。
参考答案:(1)A.Na2CO3? B.AgNO3? C.Fe2(SO4)3? D.AlCl3? E.Ba(OH)2 (各1分)
(2)CO32-+H?2O HCO3-+OH-?(2分)
HCO3-+OH-?(2分)
(3)③Fe+2Fe3+=3Fe2+?(2分)?④Al3++4OH-=AlO2-+2H2O?(2分)
本题解析:(1)在B的溶液中逐滴加入氨水有白色沉淀生成,继续加氨水至过量,沉淀消失,所以B是硝酸银;在C的溶液中加入铁粉,溶液的质量增加,则C中含有铁离子;在D的溶液中加入过量的Ba(OH)2溶液,没有沉淀,说明D中没有SO42-,所以C是硫酸铁;A和E的溶液显碱性,0.1mol·L-1A溶液的pH小于13,所以A是碳酸钠,则E是氢氧化钡,D是氯化铝。
(2)碳酸钠是强碱弱酸盐,水解显碱性,方程式是CO32-+H?2O HCO3-+OH-。
HCO3-+OH-。
(3)写出③、④的离子方程式分别是Fe+2Fe3+=3Fe2+、Al3++4OH-=AlO2-+2H2O。
本题难度:一般
4、填空题 KMnO4酸性溶液与草酸(H2C2O4)溶液反应时,溶液紫色会逐渐褪去。某探究小组用测定此反应溶液紫色消失所需时间的方法,研究外界条件对反应速率的影响。该实验条件作如下限定:
①所用KMnO4酸性溶液的浓度可选择:0.02 mol·L-1、0.002 mol·L-1;
②所用H2C2O4溶液的浓度可选择:0.2 mol·L-1、0.4 mol·L-1;
③每次实验时KMnO4酸性溶液的用量均为4 mL、H2C2O4溶液的用量均为2mL。
(1)若要探究反应物浓度、温度、催化剂对反应速率的影响,通过变换这些实验条件,至少需要完成____?组实验进行对比即可得出结论。
(2)在其它条件相同的情况下,某同学改变KMnO4酸性溶液的浓度,测得实验数据(从混合振荡均匀开始计时)如下表所示:
KMnO4酸性溶液浓度
(mol·L-1)
| 溶液褪色所需时间(min)
| ?
|
第一次
| 第二次
| 第三次
|
0.02
| 14
| 13
| 11
|
0.002
| 6.7
| 6.6
| 6.7
|
| | | |
|
?
①用0.002 mol/L KMnO4酸性溶液进行实验时,KMnO4的平均反应速率(忽略混合前后溶液体积变化)。
②依据表中数据,不能得出“溶液的褪色所需时间越短,反应速率越快”的结论。某同学设计以下方案,可以直接得出“褪色时间越短,反应的速率越快”结论。
KMnO4酸性溶液
| H2C2O4溶液
|
浓度/ mol/L
| 体积(ml)
| 浓度/ mol/L
| 体积(ml)
|
0.02
| 2
| b
| 4
|
a
| 2
| c
| 4
|
?
则表中a=?;b=?;c= ??。
(3)草酸电离常数:Ka1=5.9×10-2,Ka2=6.4×10-5。与KMnO4反应时,它将转化为CO2和H2O。
①草酸与酸性高锰酸钾溶液反应的离子方程式为?。
②室温下,0.1mol·L-1 KHC2O4酸溶液中pH?7,理由是?。
(4)测得某次实验(恒温)时溶液中Mn2+物质的量与时间关系如图。请解释n(Mn2+)在反应起始时变化不大、一段时间后快速增大的原因:?。
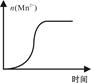
参考答案:(1)4;
(2)①2×10-4mol/(L·min)
②0.02? 0.2或0.4? 0.4或0.2
(3)①5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O
②<?因为HC2O4-的电离程度大于HC2O4-的水解程度?
(4)Mn2+对该反应有催化作用
本题解析:(1)若要探究反应物浓度、温度、催化剂对反应速率的影响,通过变换这些实验条件,首先要在一定温度下,用一种浓度的KMnO4酸性溶液和H2C2O4进行实验作对照。然后通过改变KMnO4或H2C2O4的浓度来关系反应的快慢以测定浓度对反应速率的影响;再进行其它的条件不变,通过改变反应温度来测定反应速率,来实现温度对反应速率的影响;最后进行其它条件不变,加入催化剂来观察反应速率的快慢实现催化剂对反应速率的影响的实验。因此至少需要完成4组实验进行对比即可得出结论。(2)①用0.002 mol/L KMnO4酸性溶液进行实验时,Δt=(6.7+6.6+6.7)÷3=20/3min.v(KMnO4)=Δc÷Δt ="0.002" mol/L×4÷(4+2) ÷20/3min=2×10-4mol/(L·min)。②若要得出“褪色时间越短,反应的速率越快”结论应该只改变一个量,其它都相同,观察褪色时间的长短。a=0.02;b=0.2,c=0.4或a=0.02;b=0.4,c=0.2.(3)①由电离平衡常数可知草酸是弱酸。因此根据氧化反应反应的规律及离子方程式的拆写原则可得:草酸与酸性高锰酸钾溶液反应的离子方程式为5H2C2O4+2MnO4-+6H+= 2Mn2++ 10CO2↑+8H2O。②室温下,草酸电离常数:Ka1=5.9×10-2,Ka2=6.4×10-5可知草酸氢根离子的电离作用大于其水解作用,所以溶液呈酸性。pH<7.(4)n(Mn2+)在反应起始时变化不大,速率也变化不大,一段时间后由于n(Mn2+)增多,反应速率快速增大是因为Mn2+对该反应有催化作用。
本题难度:一般
5、选择题 下列溶液通入过量CO2后,最终溶液中有沉淀析出的是
[?]
A、Na2SO3
B、BaCl2
C、Ca(ClO)2
D、Na[Al(OH)4]
参考答案:D
本题解析:
本题难度:简单