微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 向MgSO4和Al2(SO4)3的混合溶液中,逐滴加入NaOH溶液。下列图象中,能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积,纵坐标表示反应生成沉淀的质量)
[? ]
A.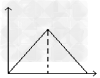
B.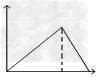
C.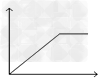
D.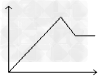
参考答案:D
本题解析:
本题难度:一般
2、填空题 (6分)A、B、C、D四种可溶性盐,阳离子分别可能是Ba2+、Na+、Ag+、Cu2+中的某一种,阴离子分别可能是NO3-、SO42-、Cl-、CO32-中的某一种。根据你所学习的知识回答下列问题:①把四种盐分别溶于盛有蒸馏水的试管中,只有C盐的溶液呈蓝色。②向①的四支试管中分别加入盐酸,B盐有沉淀生成,D盐有无色无味气体溢出。
(1)四种盐的化学式分别为:A、_______;B、___________;C、__________;D、________。
(2)写出A与B、A与C反应的离子方程式:
A+B:??;A+C:?
参考答案:(每空一分,共6分)
(1)A、BaCl2?B、AgNO3? C、CuSO4? D、Na2CO3
(2)A+B:Ag++Cl-==AgCl↓? A+C:? Ba2++SO42-==BaSO4↓
本题解析:因为银离子只能和NO3-结合,所以一定有硝酸银。同样分析可知,Ba2+就只能和氯离子结合,所以一定有氯化钡。C盐的溶液呈蓝色,说明C中含有铜离子。由于铜离子不能和CO32-大量共存,所以C是硫酸铜。B和盐酸反应生成白色沉淀,所以B是硝酸银。D和盐酸反应生成气体,所以D就只能是碳酸钠,因此A是氯化钡。
点评:进行物质的检验时,要依据物质的特殊性质和特征反应,选择适当的试剂和方法,准确观察反应中的明显现象,如颜色的变化、沉淀的生成和溶解、气体的产生和气味、火焰的颜色等,进行判断、推理、验证即可。
本题难度:一般
3、选择题 在稀溶液中能大量共存,加入NaOH溶液后有沉淀析出,加入盐酸后有气体逸出的一组离子是
A.Na+、S、Cu2+、Cl-
B.Na+、Ca2+、Cl-、HC
C.K+、Na+、N、C
D.Ca2+、K+、S、C
参考答案:B
本题解析:分析:根据离子之间能结合生成水、气体、沉淀等,则离子不能共存,并结合加入NaOH溶液生成沉淀和加入盐酸生成气体来解答.
解答:A.该组离子之间不反应,能共存,加NaOH生成氢氧化铜沉淀,加盐酸不反应,故A不选;
B.该组离子之间不反应,能共存,加NaOH生成碳酸钙沉淀,加盐酸生成二氧化碳气体,故B选;
C.该组离子之间不反应,能共存,加NaOH不反应,故C不选;
D.Ca2+分别与CO32-、SO42-结合生成沉淀,不能共存,故D不选;
故选B.
点评:本题考查离子的共存问题,熟悉离子之间的反应是解答本题的关键,题目难度不大,并注意信息的综合应用来解答.
本题难度:简单
4、选择题 下列反应可用H++OH-=H2O表示的是
A.HCl+NH3·H2O
B.HCl+Ba(OH)2
C.H2SO4+Fe(OH)3
D.CH3COOH+NaOH
参考答案:B
本题解析:A中NH3·H2O为弱碱,C中Fe(OH)3不溶,D中CH3COOH为弱酸.
本题难度:简单
5、选择题 在100mLCuSO4的溶液中,用石墨作电极电解一段时间,两极均收到2.24L气体(标准状况),则原溶液中,Cu2+的物质的量浓度为
A.1mol?L―1
B.2mol?L―1
C.3 mol?L―1
D.4 mol?L―1
参考答案:A
本题解析:考查电解池的有关计算和电极产物的判断。惰性电极电解硫酸铜溶液,阳极失去电子,OH-放电,发生氧化反应生成氧气,电极反应式为4OH--4e-=2H2O+O2↑。阴极铜离子放电,发生还原反应析出单质铜,电极反应式为2Cu2++4e-=2Cu。应用两极均收集到气体,说明铜离子不足,当铜离子放电完毕之和,溶液中的氢离子开始在阴极放电,电极反应式为4H++4e-=2H2↑。氧气和氢气的物质的量都是0.1mol,所以根据电子得失是知铜离子的物质的量应是0.1mol,所以浓度是1.0mol/L。答案是A。
本题难度:一般