微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关化学用语的表示方法中错误的是(?)
A.氨气的电子式:
B.S2-的结构示意图: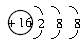
C.O—18的原子符号: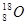
D.CO2分子的结构式:O=C=O
参考答案:A
本题解析:氨气的电子式中的氮原子缺少两个电子(即一对孤对电子)。
本题难度:一般
2、选择题 设NA为阿伏加德罗常数的数值,下列说法正确的是(? )
A.10gNH3含有4NA个电子
B.0.1mol铁和0.1mol铜分别与0.1 mol氯气完全反应,转移的电子数均为0.2NA
C.标准状况下,22.4 L H2O中分子数为NA 个
D.1L 0.1 mol·L-1Na2CO3溶液中含有0.1NA个CO32-
参考答案:B
本题解析:NH3是10电子物质,10g NH3含有的电子数不是4NA个,A错误;0.1mol铁和0.1mol铜分别与0.1 mol氯气完全反应,2个反应中均是0.1mol氯气完全反应,所以转移的电子数均是0.2 NA ,B正确;标况下水是液体,不能用摩尔体积计算分子数,C错误;碳酸钠溶液中的碳酸根离子发生水解,所以D错误;故选B。
本题难度:一般
3、选择题 U常见化合价有+4和+6,硝酸铀酰[UO2(NO3)2]加热可发生如下分
[UO2(NO3)2]--UxOy+NO2↑+O2↑(未配平),将气体产物收集于试管中并倒扣于盛水的水槽中,气体全部被吸收,水充满试管.则生成的铀的氧化物化学式是( )
A.UO2
B.2UO2?UO3
C.UO3
D.UO2?2UO3
参考答案:将二氧化氮、氧气收集于试管中并倒扣于盛水的水槽中,气体全部被吸收,发生反应4NO2+O2+2H2O=4HNO3,根据原子守恒,将UO2(NO3)2改写成UO3?2NO2?12O2,故生成铀的氧化物化学式是UO3,故选C.
本题解析:
本题难度:一般
4、选择题 7.6克铜镁合金完全溶解于250mL密度为1.4g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体5.6L(标准状况),向反应后的溶液中加入1.0mol/L的KOH溶液,当金属离子全部沉淀时,得到12.7克沉淀。下列说法不正确的是
A.该浓硝酸的物质的量浓度是14.0mol/L
B.得到12.7克沉淀时,加入的KOH溶液的体积是3.2L
C.该合金中铜与镁的物质的量之比是1:2
D.NO2和N2O4的混合气体中,N2O4的体积分数是20%