微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 我国稀土矿资源丰富,品位甚高。提取稀土元素可以向含RE(RE表示稀土元素)的硫酸盐溶液中加入粉状Na2SO4,使稀土元素转入沉淀。有关的反应为(RE)2(SO4)3+Na2SO4+xH2O (RE)2(SO4)3·Na2SO4·xH2O↓。下列叙述不正确的是(?)
(RE)2(SO4)3·Na2SO4·xH2O↓。下列叙述不正确的是(?)
A.该反应属于化合反应
B.该反应属于可逆反应
C.生成的产物在分类上属于复盐
D.RE在化合物中的化合价为+3
参考答案:B
本题解析:该反应“多变一”,属于化合反应,A正确;该反应的正、逆过程不是同条件,也不同时,不是可逆反应,B不正确;生成物中含有两种金属阳离子、一种酸根阴离子,符合复盐的定义,C正确。
本题难度:一般
2、简答题 白磷(P4)是磷的单质之一,易氧化,与卤素单质反应生成卤化磷.卤化磷通常有三卤化磷或五卤化磷,五卤化磷分子结构如图所示.该结构中氯原子有两种不同位置.
(1)6.20g白磷在足量氧气中完全燃烧生成氧化物,反应所消耗的氧气在标准状况下的体积为______?L.
上述燃烧产物溶于水配成50.0mL磷酸(H3PO4)溶液,该磷酸溶液的物质的量浓度为______?mol/L.
(2)含0.300mol?H3PO4的水溶液滴加到含0.500mol?Ca(OH)2的悬浮液中,反应恰好完全,生成1种难溶盐和16.2g?H2O.该难溶盐的化学式可表示为______.
(3)白磷和氯、溴反应,生成混合卤化磷PCl5-xBrx(1≤x≤4,且x为整数).
如果某混合卤化磷共有3种不同结构(分子中溴原子位置不完全相同的结构),该混合卤化磷的相对分子质量为______.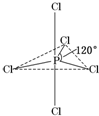
参考答案:(1)n(P4)=6.20g124g/mol=0.05?mol
则:P4+5O2 ?点燃?.? 2P2O5
? ?1mol?5mol? 2mol
? 0.05?mol?x?y
所以x=0.05mol×5=0.25?mol
y=0.05mol×2=0.1?mol
故V(O2)=0.25?mol×22.4?L/mol=5.6?L
根据磷原子守恒可判断0.1molP2O5与水反应生成0.2mol?H3PO4
则c(H3PO4)=0.2mol0.05L=4.00?mol/L,
故答案为:5.6,4.00?mol/L;
(2)n(H2O)=16.2g18g/mol=0.9?mol
由原子守恒可得生成难溶盐中含0.5?mol?Ca、0.3?mol?P、0.1?mol?H和1.3?mol?O,即难溶盐中N(Ca):N(P):N(H):N(O)=5:3:1:13,其化学式为Ca5(PO4)3(OH),
故答案为:Ca5(PO4)3(OH);
(3)混合卤化磷中分子结构有3种的是PCl3Br2和PCl2Br3,其相对分子质量为297.5和342.
故答案为:297.5或342.
本题解析:
本题难度:一般
3、选择题 下列颜色变化过程中有化学反应发生的是
A.蛋白质遇浓硝酸变黄
B.葡萄糖溶液与氢氧化铜悬浊液混合加热产生砖红色沉淀
C.活性炭使稀的红色墨水褪色
D.无色浓硝酸久置后变黄
参考答案:ABD
本题解析:C、活性炭是红色墨水褪色,是用到它的吸附作用,为物理变化。其他都伴随物质的变化,为化学变化。
本题难度:一般
4、填空题 (10分)实验室常用二氧化锰和浓盐酸反应制取氯气,反应式如下:
MnO2+ 4HCl(浓)=MnCl2+Cl2↑+2H2O
(1)用双线桥法表示上述反应中电子转移的方向和数目。
(2)反应中发生氧化反应的物质是___________(填化学式),被还原的元素是___________(填元素名称)。
(3)氧化剂与还原剂的物质的量之比为_________________。
(4)若反应中被氧化的盐酸为1mol,则生成的氯气体积为 (标准状况下)。
参考答案:(10分)(1)

(2) HCl 锰
(3) 1
本题解析:
本题难度:一般
5、选择题 氧化还原反应实质是( ? )
A.是否有元素的电子转移
B.是否有元素的化合价的变化
C.是否有氧元素的参加
D.是否有原子的重新组合
参考答案:A
本题解析:氧化还原反应实质是电子的转移,而化合价变化是表现,答案选A。
点评:凡是有元素化合价升降的反应都是氧化还原反应,而实质是电子的转移。判断的依据是看化合价是否发生变化。
本题难度:简单