微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 埋在地下的输油铸铁管道,在下列各种情况下被腐蚀速度最慢的是( )
A.在含铁元素较多的酸性土壤中
B.在潮湿疏松透气的土壤中
C.在干燥致密不透气的土壤中
D.在含碳粒较多、潮湿透气的土壤中
参考答案:A、在呈酸性的潮湿土壤中,铁的锈蚀速度很快;
B、在潮湿、疏松、透气的土壤中,铁易生锈;
C、在干燥、致密、不透气的土壤中,铁不易生锈;
D、在含沙粒较多的潮湿土壤中,铁与水和氧气同时接触,易生锈;
故选C.
本题解析:
本题难度:一般
2、填空题 (8分)[化学—化学与技术]
粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不反应)。在实验室条件下以硫酸铜溶液为电解液,用电解的方法对粗铜提纯,并对阳极泥和电解液中金属进行回收和含量测定。回答以下问题;
(1)步骤一:电解精制:电解过程中,硫酸铜的浓度会?(选填:变大、不变、变小)。
步骤二:电解完成后,对电解液进行处理。
(2)阳极泥的综合利用:
稀硝酸处理阳极泥得到硝酸银稀溶液,请写出该步反应的离子方程式:?。
残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的知识,以下是他们获取的一些信息:
序号
| 反应
| 平衡常数
|
1
| Au + 6HNO3(浓)= Au(NO3)3 + 3NO2↑+ 3H2O
| << 1
|
2
| Au3+ + 4Cl— =? AuCl4—
| >>1
|
从中可知,金很难与硝酸反应,但却可溶于王水(浓硝酸与盐酸按体积比l:3的混合物).请你简要解释金能够溶于王水的原因?。
(3)电解液含量的测定:下图是该小组探究电解液的一个实验流程:
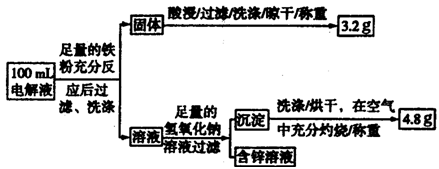
则100mL滤液中Cu2+的浓度为?mol·L—1,Fe2+的浓度为?mol·L—1
参考答案:31.(8分)(1)变小(1分)(2)3Ag+4H++NO-3==3Ag++NO ↑+2H2O(1分)
(3)浓盐酸中含大量Cl-,Au3+与Cl-1形成稳定AuCl-4,使反应2平衡向右移动,促使反应1向右进行,则金溶于王水(2分)
(4)0.5 mol/L) 2分)0.6mol/L(2分)
本题解析:
分析:步骤一:根据电解精炼铜时,阳极和阴极所发生的反应来回答;
步骤二、(1)金属银可以和稀硝酸反应生成硝酸银、一氧化氮和水;根据化学平衡移动原理来分析金能够溶于王水的原因;
(2)根据化学反应原理来计算回答.
解答:解:步骤一:在电解精炼铜时,阳极反应是金属锌、铁、镍等先失电子,而此时阴极上是铜离子已经得电子,即铜离子已经减小了而还未在阳极上产生铜离子,故答案为:变小;
步骤二:(1)金属银可以和稀硝酸反应生成硝酸银、一氧化氮和水,即3Ag+4H++NO3-=3Ag++NO↑+2H2O,根据表中的信息,Au+6HNO3(浓)=Au(NO3)3+3NO2↑+3H2O,并且Au3++4Cl-=AuCl4-,在王水中,含有浓硝酸和浓盐酸,浓盐酸含有大量氯离子,Au3+离子与氯离子形成稳定的AuCl4-离子,使反应2平衡向右移动,则金溶于王水中,
故答案为:3Ag+4H++NO3-=3Ag++NO↑+2H2O;浓盐酸含有大量氯离子,Au3+离子与氯离子形成稳定的AuCl4-离子,使反应2平衡向右移动,则金溶于王水中;
(2)100mL的滤液中含有亚铁离子、铜离子、锌离子,当加入足量的金属Fe以后,会将金属铜全部置换出来,所以生成的3.2g金属是Cu,所以铜离子的浓度c=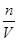 =
=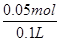 ="0.5" mol/L,亚铁离子和氢氧化钠反应生成氢氧化亚铁,在空气中更易被氧化为氢氧化铁,受热分解生成的氧化铁的质量是4.8g,根据原子守恒,亚铁离子的物质的量是:
="0.5" mol/L,亚铁离子和氢氧化钠反应生成氢氧化亚铁,在空气中更易被氧化为氢氧化铁,受热分解生成的氧化铁的质量是4.8g,根据原子守恒,亚铁离子的物质的量是: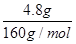 ×2
×2
=0.06mol,所以亚铁离子的浓度c=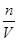 =
=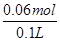 =0.6mol/L,故答案为;0.5;0.6.
=0.6mol/L,故答案为;0.5;0.6.
点评:本题涉及有关电解精炼铜、化学平衡移动原理以及物质的含量的测定的综合知识,考查角度广,难度较大.
本题难度:一般
3、选择题 化学知识广泛应用于生产、生活中,下列叙述正确的是( )
A.钢铁制品被锈蚀主要是因为钢铁中含有碳而发生原电池反应,因此生铁炼钢时要尽可能完全除去生铁中的碳
B.海水淡化和工业生产及生活的废水再利用,是解决缺水问题的有效途径之一
C.高铁酸钠Na2FeO4和Cl2O都能作为净水剂,其原理完全相同
D.液氯罐泄漏时,可将其移入水塘中,并向水塘中加入生石灰
参考答案:A、若将生铁中的碳全部除去,得到纯铁,其机械性能远远低于铁合金,所以不能将生铁中的碳全部除去,故A错误;
B、海水淡化和废水处理再利用已经是成熟技术,所以海水淡化和工业生产及生活的废水再利用,是解决缺水问题的有效途径之一,故B正确;
C、Na2FeO4净水有两个主要作用:一是+6价的铁具有极强的氧化性,从而具有杀菌消毒效果,同时被还原为+3价的铁;二是Fe3+水解产生Fe(OH)3胶体,能吸附水中的悬浮物;而Cl2O作为净水剂时,只是起到杀菌消毒效果,所以二者原理不同,故C错误;
D、Cl2能与Ca(OH)2反应生成氯化钙和次氯酸钙,从而除去氯气,故D正确;
故选BD.
本题解析:
本题难度:一般
4、填空题 甲、乙两池的电极材料如图所示,请按要求回答下列问题:
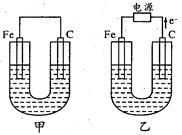
(1)若两池中均为Cu(NO3)2溶液,反应一段时间后:
①有红色物质析出的是甲池中的?(填“铁”或“碳”)棒;乙池中的?(填
“阴”或“阳”)极。
②乙池中阳极上发生的电极反应方程式是?。
(2)若两池中均为饱和NaCl溶液:
①写出乙池中总反应的化学方程式:?。
②甲池中碳极上电极反应方程式是?,乙池碳极上
电极反应属于?(填“氧化反应”或“还原反应”)。
③将湿润的淀粉KI试纸放在乙池碳极附近,发现试纸变蓝,待一段时间后又发现
蓝色褪去。这是因为过量的Cl2将生成的I2又氧化。若反应的C12和I2物质的量
之比为5:1,且生成HCl和另一种强酸,该强酸的化学式为?。
④若乙池中转移0.1 mol e-后停止实验,池中溶液体积是1L,则溶液混匀后的pH=?(不考虑所生成的气体溶解在溶液中的情况)
参考答案:(1)①碳?阴?② 4OH- -4e- =2H2O+O2↑
(2) ①2NaCl+2H2O=Cl2↑ +H2↑ +2NaOH
②2H2O+O2+4e-=4OH- ?氧化反应
③HIO3?④13
本题解析:试题分析:
甲没有外接电源,所以是原电池,铁作负极,碳作正极;乙有外接电源,所以是电解池,根据电子的流向判断,铁作阴极,碳作阳极;
(1)①甲池中的 正极发生还原反应,有金属析出,所以是碳棒;乙池中的阴极发生还原反应,有金属析出,所以是铁棒;故答案为:碳;阴.
②乙池中阳极上发生氧化反应,氢氧根离子的放电能力大于硝酸根离子的放电能力,所以是氢氧根离子失电子生成氧气和水,故答案为:4OH--4e-═O2↑+2H2O
(2)①氯化钠溶液中存在的离子是:氯离子、氢氧根离子、钠离子、氢离子,氯离子的放电能力于氢氧根离子,氢离子的放电能力大于钠离子,所以该反应的生成物是氯气、氢气、氢氧化钠.
故答案为:2H2O+2NaCl  2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
②在中性溶液中,溶有一定量的氧气,此时会发生吸氧腐蚀,负极上铁失电子,正极上氧气和水得电子生成氢氧根离子,乙池中碳棒作阳极,阳极上发生氧化反应,
故答案为:O2+4e-+2H2O═4OH-;氧化反应。
③乙池碳极附近氯离子放电生成氯气,氯气氧化KI生成碘单质遇淀粉变蓝,离子反应为Cl2+2I-═I2+2Cl-,过量的Cl2将生成的I2又氧化.若反应的Cl2和I2物质的量之比为5:1,且生成两种酸,Cl元素的化合价降低,生成盐酸,I元素的化合价升高,由电子守恒可知,5×2×(1-0)=1×2×(x-0),解得x=+5,生成物为碘酸,该化学反应为5Cl2+I2+6H2O═2HIO3+10HCl,故另一种强酸为HIO3。
故答案为:HIO3
④乙池中电解氯化钠溶液时,阳极上氯离子放电,阴极上氢离子放电,所以电池反应式为:2H2O+2NaCl  2NaOH+H2↑+Cl2↑,当有0.1mol电子转移时,生成氢氧化钠的物质的量是0.1mol,则生成氢氧化钠的物质的量浓度=0.1mol/1L=0.1mol/L,则OH-的浓度是0.1mol/L,即pH=13。
2NaOH+H2↑+Cl2↑,当有0.1mol电子转移时,生成氢氧化钠的物质的量是0.1mol,则生成氢氧化钠的物质的量浓度=0.1mol/1L=0.1mol/L,则OH-的浓度是0.1mol/L,即pH=13。
故答案为:13
本题难度:一般
5、填空题 (12分)如图所示,组成一种原电池。试回答下列问题(灯泡功率合适):
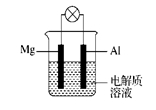
(1)电解质溶液为稀H2SO4时,灯泡?(填“亮”或“不亮”)。若灯泡亮,则Mg为原电池的?极;若灯泡不亮,其理由为?。
(2)电解质溶液为NaOH溶液时,灯泡?(填“亮”或“不亮”)。若灯泡亮,则Al做原电池的?极。若灯泡不亮,其理由为?。
(3) 铝的阳极氧化,是一种常用的金属表面处理技术,它能使铝的表面生成一层致密的氧化膜,该氧化膜不溶于稀硫酸。某化学研究小组在实验室中按下列步骤模拟该生产过程。
按图取两片质量相当的铝片组装好仪器,接通开关K,通电约25 min。在阳极生成氧化铝,阴极产生气体。写出该过程中的阳极反应式:______________________________。
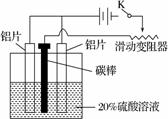
如果此时取出两极,用蒸馏水洗净,晾干后称重发现两个电极质量差为0.8克,计算阴极产物在标准状态下的体积并写出计算过程。
参考答案:(12分) (1)亮? 负极?硫酸太稀,没有足够的阴、阳离子
(2)亮 ?负极 电解质中没有足够的阴、阳离子
(3)负极:2Al+3H2O-6e-===Al2O3+6H+
阴极产物为氢气。标准状况下体积为1.12升
本题解析:(1)形成原电池的条件:活性不同的两个电极、电解质溶液形成闭合回路。
(2)虽然镁的活泼相对铝较强,但它不能和碱液反应,而铝却可与其反应,失电子作负极;
(3)由题意知,铝极失电子形成氧化膜。即:
阳极:2Al+3H2O-6e-===Al2O3+6H+
阴极为:H++2e+=H2↑
可得关系式: 3 H2↑? ~? 3O(两极质量差)
_? 22.4:L? 16g
即:? 1.12L? 0.8g
本题难度:一般