微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 二氧化铈(CeO2)是一种重要的稀土氧化物.平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2等物质).某课题以此粉末为原料,资源回收的工艺流程如下:
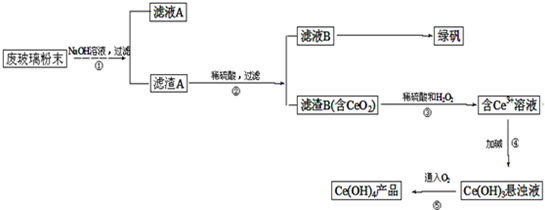
(1)写出第①步反应的离子方程式______.
(2)洗涤滤渣B的目的是为了除去______(填离子符号),检验该离子是否洗净的方法是______.
(3)写出第③步反应的化学方程式______.
(4)制备绿矾(FeSO4?7H2O)时,向Fe2(SO4)3溶液中加入过量铁屑,充分反应后,经过滤得到FeSO4溶液,再经______、过滤、洗涤、干燥等操作步骤得到绿矾.
(5)取上述流程中得到的Ce(OH)4产品(质量分数为97%)1.0g,加硫酸溶解后,用0.1000mol/LFeSO4溶液滴定至终点(铈被还原成Ce3+),则需准确滴加标准溶液的体积为______mL.(保留小数点后两位Ce-140)
(6)写出第⑤步反应的化学方程式______.
参考答案:(1)根据废玻璃粉末的成分(含SiO2、Fe2O3、CeO2等物质),可知能与氢氧化钠反应的是二氧化硅,其离子方程式为SiO2+2OH-═SiO32-+H2O,
故答案为:SiO2+2OH-═SiO32-+H2O;
(2)经分析滤渣A的成分是Fe2O3、CeO2;第②步反应Fe2O3与稀硫酸作用生成Fe2(SO4)3,洗涤滤渣B的目的显然是为了除去 Fe3+,检验铁离子是否洗净的方法是取最后一次洗涤液,加入KSCN溶液,若不出现红色,则已洗净;否则未洗净,
故答案为:Fe3+;取最后一次洗涤液,加入KSCN溶液,若不出现红色,则已洗净;否则未洗净;
(3)第③步反应CeO2与H2O2和稀H2SO4反应生成Ce3+,Ce元素由+4价变为+3价,被还原;则H2O2应被氧化生成O2,然后配平得出第③步反应的化学方程式 2CeO2+H2O2+3H2SO4═2Ce2(SO4)3+O2↑+4H2O,
故答案为:2CeO2+H2O2+3H2SO4═2Ce2(SO4)3+O2↑+4H2O;
(4)绿矾(FeSO4?7H2O)是结晶水合物,固体加热易分解;故由FeSO4溶液制备绿矾(FeSO4?7H2O)时,应经 蒸发浓缩、冷却结晶、过滤、洗涤、干燥等操作步骤得到,
故答案为:蒸发浓缩、冷却结晶;
(5)由已知条件:取上述流程中得到的Ce(OH)4产品(质量分数为97%)1.0g,加硫酸溶解后得Ce4+,用0.1000mol/LFeSO4溶液滴定至终点,铈被还原成Ce3+,则Fe2+被氧化为Fe3+,根据守恒列式n(Ce(OH)4)=n(FeSO4)=1.0g×97%208g/mol=0.004663mol,可得需准确滴加标准溶液的体积=0.004663mol0.1000mol/L=0.04663L=46.63mL,
故答案为:46.63;
(6)第⑤步反应Ce(OH)3悬浊液被空气中的氧气氧化生成Ce(OH)4,反应的化学方程式为:4Ce(OH)3+O2+2H2O═4Ce(OH)4,
故答案为:4Ce(OH)3+O2+2H2O═4Ce(OH)4.
本题解析:
本题难度:一般
2、选择题 对一块铁进行防护,下列方法不正确的是
[? ]
A.合金
B.涂油
C.漆合金
D.埋在地下
参考答案:D
本题解析:
本题难度:简单
3、选择题 (3分)(2012?山东)下列与金属腐蚀有关的说法正确的是( )
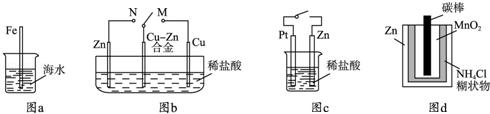
A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图b中,开关由M改置于N时,Cu﹣Zn合金的腐蚀速率减小
C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图d中,Zn﹣MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的
参考答案:B
本题解析:A.当溶液中氧气浓度越大时电化学腐蚀越严重;
B.开关由M改置于N时,Zn为负极,合金被保护;
C.气体在Pt上放出;
D.MnO2发生还原反应.
解:A.图a中,铁棒发生化学腐蚀,靠近底端的部分与氧气接触少,腐蚀程度较轻,故A错误;
B、图b中开关由M置于N,Cu﹣Zn作正极,腐蚀速率减小,故B正确;
C.图c中接通开关时Zn作负极,腐蚀速率增大,但氢气在Pt上放出,故C错误;
D.图d中干电池放电时MnO2发生还原反应,体现锌的还原性,故D错误.
故选B.
点评:本题考查金属的腐蚀及防护,题目难度不大,注意把握原电池的工作原理.
本题难度:一般
4、简答题 下列各装置中(见下图)能构成原电池的写出电极反应式;不是原电池的说明原因。
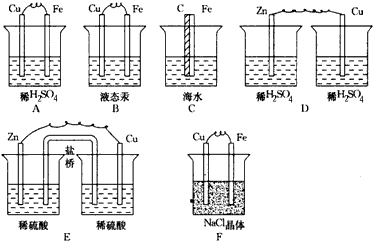
参考答案:装置A:是原电池。 负极(Fe):Fe-2e-=Fe2+ 正极(Cu):2H++2e-=H2↑
装置B:不能构成原电池。原因是液态汞不是电解质溶液。
装置C:是原电池。 负极(Fe):2Fe-4e-=2Fe2+ 正极(C):O2+2H2O+4e-=4OH-
装置D:不能构成原电池,原因是没有形成闭合回路。
装置E:是原电池(有盐桥,可构成闭合回路)。 负极(Zn):Zn-2e-=Zn2+ 正极(Cu):2H++2e-=H2↑
装置F:不能构成原电池。因为烧杯中装的不是电解质溶液,而是NaCl晶体,NaCl晶体不导电,故不能形成闭合回路。
本题解析:
本题难度:一般
5、实验题 碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病,KI、K1O3曾先后用于加碘盐中。
(1)工业上可以通过铁屑法生产KI,其工艺流程如下:
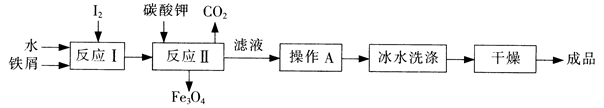
①反应I生成铁与碘的化合物,若该化合物中铁元素与碘元素的质量比为21:127,则加入足量碳酸钾时,反应Ⅱ的化学方程式为??。
②操作A包括??;用冰水洗涤的目的是??。
(2)KIO3可以通过H2O2氧化I2先制得HIO3,然后再用KOH中和的方法进行生产。
①烹饪时,含KIO3的食盐常在出锅前加入,其原因是??,
②若制得1284 kg KIO3固体,理论上至少需消耗质量分数为30%的双氧水??kg。
③KIO3还可通过下图所示原理进行制备。电解时总反应的离子方程式为 ??。若忽略溶液体积的变化,则电解结束后阴极区的pH与电解前相比?(选填“增大”、“减小”或“不变”)。
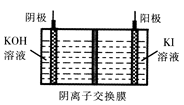
参考答案:
(1)①Fe3I8+4K2CO3=Fe3O4+8KI+4CO2↑
②加热浓缩、冷却结晶、过滤?洗涤除去表面可溶性杂质,同时减少KI的溶解损失
(2)①在较高温度下K1O3易分解?②1700?③I一+3H2O  IO3一+3H2↑?增大
IO3一+3H2↑?增大
(每空2分,本题共14分)
本题解析:工业流程题,(1)①根据化合物中铁元素与碘元素的质量比为21:127计算出原子个数比,得出化学式Fe3I8,根据反应物和产物书写化学方程式;②从溶液中分离晶体一般采用降温结晶法,滤液一般为稀溶液,故要浓缩,所以操作为加热浓缩、冷却结晶、过滤;洗涤的目的是除去表面杂质,冰水、相应饱和溶液、乙醇等均是减少晶体的溶解损失;(2)①在较高温度下K1O3易分解;②反应方程式为 5H2O2+I2=2HIO3+4H2O? HIO3+KOH=KIO3+H2O,
n(H2O2)=5/2n(KIO3)=15×103mol,m(H2O2)=15×103×34÷30%=1.7×106g=1700kg
③根据图示可知,阳极:5OH-+I—-5e- =IO3? + H2O,阴极:2H++2e- =H2↑,故总方程式为I-+3H2O  IO3-+3H2↑;电解过程中氢离子放电,溶液中OH-浓度增大,pH增大。
IO3-+3H2↑;电解过程中氢离子放电,溶液中OH-浓度增大,pH增大。
本题难度:困难