微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 由金红石(TiO2) 制取单质Ti,涉及的步骤为:
TiO2→TiCl4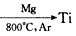 已知:
已知:
①C(s)+O2(g)=CO2(g) △H=-393.5kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H=-566kJ/mol
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) △H=+141kJ/mol
(1)则TiO2(s) +2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的△H=____________。
(2)碳在氧气中不完全燃烧生成CO的热化学方程式为_____________。
参考答案:(1)-80kJ/mol
(2)2C(s)+O2(g)=2CO(g) △H=-221 kJ /mol
本题解析:
本题难度:一般
2、填空题 “嫦娥一号”登月成功,实现了中国人“奔月”梦想.
“嫦娥一号”使用的推进剂是液氢和液氧,已知在298K时,氢气(H2)、碳(C)、辛烷(C8H18)、甲烷(CH4)燃烧的热学方程式:
H2(g)+
O2(g)═H2O(l)△H=-285.8kJ/mol
C(g)+O2(g)═CO2(g)△H=-393.8kJ/mol
C8H18(l)+O2(g)═8CO2(g)+9H2O(l)△H=-5518kJ/mol
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ/mol
相同质量的H2、C、C8H18、CH4完全燃烧时,放热最多的物质是放热最少的物质的放热量的______倍.(保留2位有效数字)
(2)已知:H2(g)═H2(l)△H=-0.92kJ/mol
O2(g)═O2(l)△H=-6.84kJ/mol
H2O(l)═H2O(g)△H=+44.0kJ/mol
请写出液氢和液氧生成气态水的热化学方程式:______.
(3)氢气、氧气不仅燃烧能释放热能,二者形成的原电池还能提供电能,美国的探月飞船“阿波罗号”使用的就是氢氧燃料电池,电解质溶液为KOH溶液,其电池反应式为:
负极:______;正极:______.
参考答案:(1)设质量都为m,相同质量的H2、C、C8H18、CH4完全燃烧时,放出热量分别是m2×285.8kJ、m12×393.5kJ、m114×5518kJ、m16×890.3kJ,最大值应为m2×285.8kJ,最小值是m12×393.5kJ,放热最多的物质是放热最少的物质的放热量的4.4倍,故答案为:4.4;
(2)①H2(g)═H2(l)△H=-0.92kJ/mol
②O2(g)═CO2(l)△H=-6.84kJ/mol
③H2O(l)═H2O(g)△H=+44.0kJ/mol
根据盖斯定律,液氢和液氧生成气态水的热化学方程式可以是③-①-12×②,焓变也是相应的代数和,所以液氢和液氧生成气态水的热化学方程式为H2(l)+12O2(l)═H2O(g)△H=-237.5kJ/mol;
(3)负极的反应中氢气失电子被氧化,氢气失电子生成氢离子,氢离子和溶液中的氢氧根离子生成水,所以电极反应式为2H2+4OH--4e-=4H2O;正极上是氧气得电子被还原,氧气得电子和水反应生成氢氧根离子,所以电极反应式为O2+2H2O+4e-=4OH-.
故答案为:2H2+4OH--4e-=4H2O;O2+2H2O+4e-=4OH-.
本题解析:
本题难度:一般
3、简答题 (1)写出H2S的电离方程式______;
(2)写出熔融状态下硫酸氢钠的电离方程式______;
(3)已知1g氢气完全燃烧生成液态水放出143KJ热量,写出表示H2燃烧热热化学方程式______;
(4)已知相同条件下:
4Ca5(PO4)3F(s)+3SiO2(s)=6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g)△H1
2Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g)△H2
SiO2(s)+CaO(s)=CaSiO3(s)△H3
4Ca5(PO4)3F(s)+2lSiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g)△H
用△H1、△H2和△H3表示△H,△H=______.
参考答案:(1)H2S属于二元弱酸,存在电离平衡,H2S电离氢离子与硫氢根离子,电离方程式为:H2S?H++HS-HS-;
硫氢根离子发生二级电离,电离出氢离子与硫离子,电离方程式为:HS-?H++S2-;
故答案为:H2S?H++HS-HS-、HS-?H++S2-;
(2)硫酸氢钠是离子化合物,由钠离子与硫酸氢根离子构成,熔融状态下电离出钠离子与硫酸氢根离子,电离方程式为:NaHSO4=Na++HSO4-;
故答案为:NaHSO4=Na++HSO4-;
(3)1g氢气的物质的量为1g2g/mol=0.5mol,所以1mol氢气完全燃烧生成液态水放出的热量为143kJ×1mol0.5mol=286kJ,所以H2燃烧热的热化学方程式为:H2(g)+12O2(g)=H2O(l)△H=-286kJ?mol-1;
故答案为:H2(g)+12O2(g)=H2O(l)△H=-286kJ?mol-1;
(4)已知:①4Ca5(PO4)3F(s)+3SiO2(s)=6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g)△H1
②2Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g)△H2
③SiO2(s)+CaO(s)=CaSiO3(s)△H3
根据盖斯定律,①+②×3+③×18得:
4Ca5(PO4)3F(s)+2lSiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g)
△H=△H1+3△H2+18△H3;
故答案为:△H1+3△H2+18△H3.
本题解析:
本题难度:一般
4、选择题 已知25℃、101kPa下,石墨、金刚石燃烧的热化学方程式分别为
C(石墨)+O2(g)=CO2(g) △H=-393.51kJ·mol-1
C(金刚石)+O2(g)=CO2(g) △H=-395.41kJ·mol-1
据此判断,下列说法中正确的是
[? ]
A.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的低
B.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的高
C.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的低
D.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的高
参考答案:A
本题解析:
本题难度:一般
5、简答题 汽车内燃机工作时产生的高温会引起N2和O2发生反应生成NO气体,是导致汽车尾气中含有NO的原因之一.
(1)如图表示在T1、T2两种不同温度下,一定量的NO发生反应:2NO(g)?N2(g)+O2(g).反应过程中N2的体积分数随时间变化的图象.升高温度,该反应的平衡常数K将______(填“增大”、“减小”或“不变”).
(2)2000℃时,向容积为2L的密闭容器中充入10mol?N2与5mol?O2,达到平衡后NO的物质的量为2mol,则2000℃时该反应的平衡常数K的数值为______.该温度下,若开始时向上述容器中充入N2与O2均为1mol,则达到平衡后N2的转化率为______.
(3)研究发现,用CH4催化还原NOx可以消除氮氧化物的污染.例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ?mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ?mol-1
若1mol?CH4还原NO2至N2,整个过程中放出的热量为______kJ.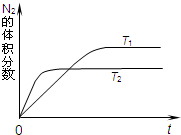
参考答案:(1)根据“先拐先平数值大”知,T1<T2,升高温度氮气的体积分数减小,平衡向逆反应方向移动,反应物浓度增大,生成物浓度减小,平衡常数K减小;
故答案为:减小;
(2)利用三段式求出反应混合物各组分物质的量的变化量、平衡时反应混合物各组分物质的量.
? N2(g)+O2(g)?2NO(g),
起始(mol):10?5?0
反应(mol):1? 1? ? 2
平衡(mol):9? 4?2
所以平衡常数k=C2(NO)C(N2)C(O2)=2mol2L9mol2L.4mol2L=19
令N2转化的物质的量为xmol,则
? ?N2(g)+O2(g)?2NO(g),
起始(mol):1? 1?0
反应(mol):x?x? 2x
平衡(mol):1-x?1-x?2x
所以2xmol2L(1-x)mol2L.(1-x)mol2L=19
解得x=17,N2的转化率为17mol1mol×100%=14.3%;
故答案为:19(或0.11),17(或14.3%);
(3)设放出的热量为y.
将两个方程式CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ?mol-1、CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ?mol-1相加得:
2CH4(g)+4NO2(g)=2N2(g)+2CO2(g)+4H2O(g)△H=-1734kJ?mol-1
2mol? 1734KJ
1mol?y?
y=867KJ
故答案为:867.
本题解析:
本题难度:一般