微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法正确的是:?
A.将氯化铝和硫酸铝溶液蒸干灼烧后均得到氧化铝
B.向足量饱和石灰水中加入0.56 g CaO,可得固体0.74 g
C.由H+(aq)+OH-(aq)===H2O(l);△H=-57.3kJ·mol-1可知,若将含1 mol
CH3COOH的稀溶液与含1 mol NaOH的稀溶液混合,放出的热量小于57.3 kJ
D.向稀醋酸中加入醋酸钠固体,溶液pH升高的主要原因是醋酸钠水解呈碱性
参考答案:C
本题解析:氯化铝溶液灼烧由于铝离子发生水解会产生氢氧化铝,由于氯化氢具有挥发性,会使平衡向水解方向移动,氢氧化铝失水产生氧化铝,但是硫酸没有挥发性,所以灼烧硫酸铝溶液不会得到氧化铝,A错误;饱和石灰水中加入氧化钙,氧化钙会与水反应生成氢氧化钙7.4g,但是溶液是饱和的溶液原溶液中也会析出溶质所以固体的质量大于7.4gB错误;向稀醋酸中加入醋酸钠固体,溶液pH升高的主要原因是醋酸的电离平衡向左移动溶液中氢离子溶液减小,D错误;醋酸是弱酸电离吸热,所以1 mol CH3COOH的稀溶液与含1 mol NaOH的稀溶液混合,放出的热量小于57.3 kJ,C正确,答案选C。
本题难度:一般
2、填空题 (1)某温度下纯水中的c(H+) = 2×10-7mol/L,则此时c(OH-) =________mol/L,该纯水的pH_______7(填“>”、“<”、“=”)。若温度不变,滴入稀硫酸使c(H+) = 5×10-6mol/L,则c(OH-) =________mol/L,由水电离出的c(H+) =________mol/L,
(2)已知在室温下,盐酸的pH=a,氢氧化钡的pH=b,且a+b=14,两者等体积混合后,溶液的pH=?。
若酸碱按体积比为1:10混合后溶液显中性,则a+b=?。
参考答案:⑴、2×10-7(2分)?<(2分)? 8×10-9(2分)? 8×10-9(2分)
⑵ 、7(2分)? 13(2分)
、7(2分)? 13(2分)
本题解析:略
本题难度:简单
3、选择题 有①②③三瓶体积相等、浓度均为1 mol/L的HCl溶液。将①加热蒸发至体积减少一半,在②中加入少量CH3COONa固体(溶液仍为酸性),③不作改变,然后以酚酞为指示剂,用标准NaOH溶液滴定上述三种溶液,终点时消耗的NaOH溶液的体积大小关系为
A.①=③>②
B.③>②>①
C.③=②>①
D.①=②=③
参考答案:C
本题解析:盐酸易挥发,加热蒸发促进氯化氢挥发,所以①中消耗的氢氧化钠最少。根据氯离子守恒可知,在选项②③中最终生成的氯化钠是相同的,所以消耗的氢氧化钠是相同的,即③=②>①,答案选C。
本题难度:一般
4、选择题 今有室温下四种溶液,有关叙述不正确的是( )
?
| ①
| ②
| ③
| ④
|
pH
| 11
| 11
| 3
| 3
|
溶液
| 氨水
| 氢氧化钠溶液
| 醋酸
| 盐酸
|
?
A.①、②中分别加入适量的氯化铵晶体后,两溶液的pH均减小
B.分别加水稀释10倍,四种溶液的pH:①>②>④>③
C.①、④两溶液等体积混合,所得溶液中c(Cl-)>c(N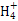 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
D.Va L ④与Vb L ②溶液混合,若混合后溶液pH=4,则Va∶Vb=11∶9
参考答案:C
本题解析:①、②中分别加入适量的氯化铵晶体后,因为铵根离子要结合氢氧根离子,溶液的碱性减弱,两溶液的pH均减小,A正确;分别加水稀释10倍,氢氧化钠pH减小1,盐酸pH增大1,氨水减小的比1小,醋酸增大的比1小,所以①>②>④>③,B正确;①、④两溶液等体积混合,由于氨水的浓度远大于盐酸的浓度,故氨水过量,溶液显碱性,因此有:c(N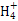 )>c(Cl-)>c(OH-)>c(H+),C错误;Va L④与Vb L ②溶液混合,若混合后溶液pH=4,
)>c(Cl-)>c(OH-)>c(H+),C错误;Va L④与Vb L ②溶液混合,若混合后溶液pH=4, =10-4,则Va∶Vb=11∶9,D正确。
=10-4,则Va∶Vb=11∶9,D正确。
本题难度:一般
5、选择题 未来氢气将作为新能源的优点的是(?)
①燃烧时发生氧化反应? ②充分燃烧的产物不污染环境
③氢气是一种再生能源? ④燃烧时放出大量热量
A.①②③
B.①②④
C.①③④
D.②③④
参考答案:D
本题解析:考查新能源的特点。燃烧都是氧化还原反应,所以选项①不是氢气作为新能源的优点,答案选D。
本题难度:简单