微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 如下图所示的锌和铜及稀硫酸组成的原电池中,有下列说法,其中不正确的是:(?)
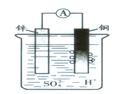
A.铜棒上有气体放出,溶液pH变大
B.锌是正极,铜是负极
C.导线中有电子流动,电子从锌极流到铜极
D.锌极上发生了氧化反应
参考答案:B
本题解析:在原电池中较活泼的金属作负极,失去电子,被氧化,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动。锌比铜活泼,锌是负极,铜是正极,溶液中的氢离子放电生成氢气。所以正确的答案是B。
本题难度:简单
2、填空题 (15分)研究碳、氮氧化物的性质与利用具有重要意义。
(1)高温时,用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量的SO2和SO3,此时反应的化学方程式是 。
②由MgO制成的Mg可构成“镁——次氯酸盐”电池,其装置示意图如图1,该电池的正极反应式为 ;
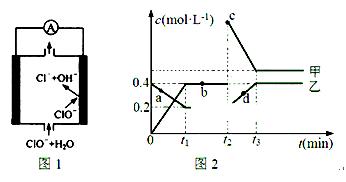
(2)化合物甲、乙是两种氮的氧化物且所含元素价态均相同,某温度下相互转化时的量变关系如图2所示:
①甲的化学式是 ;
②图中a、b、c、d四点中,表示反应处于平衡状态的是 。t1~t2时间内v正(乙) v逆(甲)(填“>”“<”或“=”)
③反应进行到t2时刻,改变的条件可能是 。
(3)用H2或CO催化还原NO可达到消除污染的目的。
已知:2NO(g) = N2(g) + O2(g) △H = -180.5kJ·mol-1
2H2O(l) = 2H2(g) + O2(g) △H = +571.6kJ·mol-1
则用H2催化还原NO消除污染的热化学方程式是 。
参考答案:(1)(1)①2MgSO4 + CO  2MgO + SO2 + CO2 + SO3 (2分)
2MgO + SO2 + CO2 + SO3 (2分)
②ClO- + 2e- + H2O = Cl- + 2OH-(2分)
(2)①NO2(2分) ②b (2分) < (2分) ③增大NO2浓度(合理均可,2分)
(3)2H2(g) + 2NO(g) = N2(g) + 2H2O(l) △H = -752.1kJ·mol-1(3分)
本题解析:(1)①750℃时,测得气体中含等物质的量的SO2和SO3,则根据原子守恒可知反应中还有氧化镁和CO2生成,因此此时反应的化学方程式是2MgSO4 + CO  2MgO + SO2 + CO2 + SO3 。
2MgO + SO2 + CO2 + SO3 。
②镁是活泼得金属,镁作负极,失去电子。次氯酸根得到电子,在正极放电,因此该电池的正极反应式为ClO- + 2e- + H2O = Cl- + 2OH-;
(2)①根据图像可知,甲与乙在相同时间内如果甲增加0.4mol/L,乙减少0.4mol/L—0.2mol/L=0.2mol/L,所以甲是NO2,乙是N2O4。
②a、c、d三点中物质得浓度均是变化的,因此一定不是平衡状态。B点物质的浓度不变,说明反应达到平衡状态,所以图中a、b、四点中,表示反应处于平衡状态的是b。t1~t2时间内反应处于平衡状态,则根据方程式N2O4 2NO2可知v正(乙)<v逆(甲)。
2NO2可知v正(乙)<v逆(甲)。
③反应进行到t2时刻,NO2浓度瞬间增大,N2O4浓度逐渐增大,所以改变的条件可能是增大NO2浓度。
(3)已知:①2NO(g) = N2(g) + O2(g) △H = -180.5kJ·mol-1,②2H2O(l) = 2H2(g) + O2(g) △H = +571.6kJ·mol-1,则根据盖斯定律可知①—②即得到用H2催化还原NO消除污染的热化学方程式为2H2(g) + 2NO(g) = N2(g) + 2H2O(l) △H = -752.1kJ·mol-1。
考点:考查原电池、外界条件对平衡状态的影响、平衡状态判断以及盖斯定律的应用
本题难度:困难
3、选择题 在理论上不能用于设计原电池的化学反应是
A.H2SO4 (aq)+BaCl2(aq)=2HCl(aq)+BaSO4(s);△H<0
(aq)+BaCl2(aq)=2HCl(aq)+BaSO4(s);△H<0
B.CH3CH2OH(l)+3O2(g)  2CO2(g)+3H2
2CO2(g)+3H2 O(l) ;△H<0
O(l) ;△H<0
C.4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s) ;△H<0
D.3Cu(s)+8HNO3(aq)=3Cu(NO3)2(aq)+2NO(g )+4H2O(l) ;△H<0
)+4H2O(l) ;△H<0