微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 一定温度下,在一容积固定的密闭容器中建立了如下平衡:2A(g)→B(g),保持温度不变,若再向容器中通入一定量的A气体或B气体,重新达到平衡后,容器A的体积分数比原平衡时( )
A.都减小
B.都增大
C.前者增大,后者减小
D.前者减小,后者增大
参考答案:保持温度不变,若再向容器中通入一定量的A气体或B气体,重新达到的平衡,可以等效为在原平衡的基础上增大压强达到的平衡,平衡向正反应方向移动,A的物质的量减少量是总物质的量减少量的2倍,故到达新平衡时A的体积分数减少,
故选:A.
本题解析:
本题难度:一般
2、选择题 在甲、乙、丙、丁四个体积相等的密闭容器中发生如下反应2A(g)+B(g) 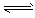 3C(g)+2D(g),若起始加入A和B的物质的量分别为:
3C(g)+2D(g),若起始加入A和B的物质的量分别为:
甲:A 2 mol B 1 mol
乙:A 1 mol B 1 mol
丙:A 2 mol B 2 mol
丁:A 1 mol B 2 mol
在相同温度下建立平衡时,A或B 的转化率大小关系为
[? ]
A.A的转化率为 甲 < 丙 < 乙 < 丁
B.A的转化率为 甲 < 乙 < 丙 < 丁
C.A的转化率为 甲 > 丙 > 乙 > 丁
D.B的转化率为 丁 > 乙 > 丙 > 甲
参考答案:A
本题解析:
本题难度:一般
3、选择题 在一密闭容器中进行下列反应:2M(g)+N(g)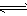 ?R(s)+Z(g) 。在反应达到平衡后保持温度不变,若缩小容器的体积,则混合气体的平均相对分子质量
?R(s)+Z(g) 。在反应达到平衡后保持温度不变,若缩小容器的体积,则混合气体的平均相对分子质量
[? ]
A.一定增大
B.一定减小
C.一定不变
D.不能确定
参考答案:D
本题解析:
本题难度:一般
4、填空题 如下图,甲、乙、丙分别表示在不同条件下可逆反应:A(g)+B(g) xC(g)的生成物 C在反应混合物中的百分含量(C%)和反应时间(t)的关系。?
xC(g)的生成物 C在反应混合物中的百分含量(C%)和反应时间(t)的关系。?
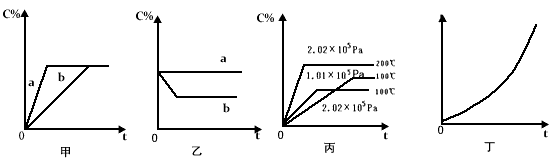
(1)若甲图中两条曲线分别代表有催化剂和无催化剂的情况,则__________曲线表示无催化剂时的情况,速率:a ________b(填:大于、小于或等于)
(2)若乙图表示反应达到平衡后,分别在恒温恒压条件下和恒温恒容条件下向平衡混合气体中充入He气后的情况,则__________曲线表示恒温恒容的情况,此时该恒温恒容中____________C% (填:变大、变小或不变)
(3)根据丙图可以判断该可逆反应的正反应是___________热反应(填:放热、吸热),计量数x的值是 ____________;
(4)丁图表示在某固定容器的密闭容器中,上述可逆反应达到平衡后,某物理量随着温度(T)的变化情况,根据你的理解,丁图的纵坐标可以是_____________,[填:①C% ②A的转化率 ③B的转化率 ④压强 ⑤c(A) ⑥c(B)];升温平衡移动的方向为________________ 。(填:左移或右移)
参考答案:(1)b ;大于
(2)a ;不变
(3)吸 ;大于2(或大于等于3)
(4)①②③④ ;右
本题解析:
本题难度:一般
5、简答题 汽车尾气(含烃类、CO、NO与SO2等)是城市主要污染源之一,治理的办法之一是在汽车排气管上装催化转化器,它使NO与CO反应生成可参与大气生态循环的无毒气体,反应原理:2NO(g)+2CO(g)?N2(g)+2CO2(g),在298K、100kPa下,△H=-113kJ/mol,△S=-145J/(mol?K).
(1)为了提高该反应的速率和NO的转化率,采取的正确措施为______.
A.加催化剂同时升高温度B.加催化剂同时增大压强
C.升高温度同时充入N2D.降低温度同时增大压强
(2)该反应达到平衡时若增大压强,则混合气体的平均相对分子质量______,若升高温度,则该反应的平衡常数______(均填“增大”、“减小”或“不变”).
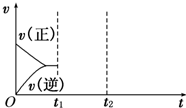
(3)在如图中画出在某时刻条件改变后的图象(其他条件不变),在______时间段CO的转化率最大.
t1:增大NO的浓度t2:降低温度
(4)通过计算判断该条件下反应能否自发进行?(要求写出计算过程)
参考答案:(1)提高该反应的速率,可以增大压强、升高温度、增大浓度或使用催化剂等,同时使NO的转化率增大,应使平衡向正反应方向移动,
A.加催化剂同时升高温度,反应速率增大,正反应为放热反应,平衡向逆反应方向移动,NO的转化率降低,故A错误;
B.加催化剂同时增大压强,反应速率增大,正反应为气体体积减小的反应,平衡向正反应方向移动,NO的转化增大,故B正确;
C.升高温度同时充入N2,反应速率增大,平衡向逆反应方向移动,NO的转化率减小,故C错误;
D.该反应正反应为体积减小的放热反应,降低温度同时增大压强,平衡向正反应方向移动,NO的转化率增大,但反应速率不一定增大,故D错误;
故答案为:B;
(2)该反应正反应方向为物质的量减小的反应,达到平衡时若增大压强,混合气体总的质量不变,总的物质的量减小,则混合气体的平均相对分子质量增大;
正反应为放热反应,若升高温度,平衡向逆反应方向移动,该反应的平衡常数减小,
故答案为:增大;减小;
(3)t1:增大NO的浓度,瞬间正反应速率增大、逆反应速率不变,平衡向正反应方向移动,t2:降低温度,瞬间正、逆反应速率都低于增大NO的浓度到达平衡时的速率,正反应为放热反应,平衡向正反应方向移动,逆反应速率降低更大,图象为: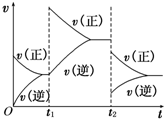 ,在t2以后达平衡时,CO的转化率最大,
,在t2以后达平衡时,CO的转化率最大,
故答案为: ;t2以后达平衡;
;t2以后达平衡;
(4)△G=△H-T?△S=-113kJ/mol+298K×145×10-3kJ/(mol?K)=-69.79kJ/mol<0,故反应能自发进行,
答:能,△G=△H-T?△S=-113kJ/mol+298K×145×10-3kJ/(mol?K)=-69.79kJ/mol<0,故反应能自发进行.
本题解析:
本题难度:一般