微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 B. [实验化学]
次硫酸氢钠甲醛(NaHSO2·HCHO·2H2O)在印染、医药以及原子能工业中应用广泛。以Na2SO3、SO2、HCHO 和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:
步骤1:在烧瓶中(装置如图 所示) 加入一定量Na2SO3和水,搅拌溶解,缓慢通入SO2,至溶液pH 约为4,制得NaHSO3溶液。步骤2:将装置A 中导气管换成橡皮塞。向烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在80 ~ 90益下,反应约3h,冷却至室温,抽滤。步骤3:将滤液真空蒸发浓缩,冷却结晶。
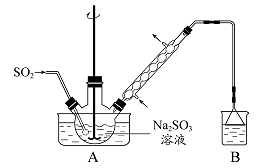
(1)装置B 的烧杯中应加入的溶液是?。
(2)①步骤2 中,反应生成的Zn(OH)2会覆盖在锌粉表面阻止反应进行,防止该现象发生的措施是??
?。②冷凝管中回流的主要物质除H2O 外还有?(填化学式)。
(3)①抽滤装置所包含的仪器除减压系统外还有?、?(填仪器名称)。②滤渣的主要成分有?、?(填化学式)。
(4)次硫酸氢钠甲醛具有强还原性,且在120益以上发生分解。步骤3 中不在敞口容器中蒸发浓缩的原因是?。
参考答案:

本题解析:(1)装置B用来吸收剩余的SO2尾气,应该用NaOH溶液吸收。(2)①防止Zn(OH)2附着在锌粉的表面可用快速搅拌的方法。②反应物中的甲醛沸点较低,具有挥发性,会在冷凝管中冷却。(3)抽滤装置还包含布氏漏斗和吸滤瓶。滤渣中含有生成的Zn(OH)2以及部分未反应的锌。(4)由题意知,次硫酸氢钠甲醛具有强还原性,真空蒸发的目的是防止其被空气中的氧气氧化。
【考点定位】化学实验模块
本题难度:一般
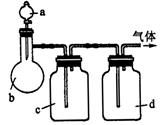
2、实验题 (9分)拟用下图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂).
气体
| a
| b
| c
| d
|
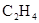
| 乙醇
| 浓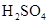
| 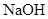 溶液 溶液
| 浓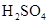
|
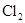
| 浓盐酸
| 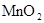
| 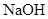 溶液 溶液
| 浓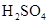
|

| 饱和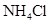 溶液 溶液
| 消石灰
| 
| 固体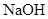
|
NO
| 稀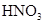
| 铜屑
| 
| 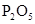
|
?
(1)上述方法中可以得到干燥、纯净的气体是____________.
(2)指出不能用上述方法制取的气体,并说明理由(可以不填满)
①气体____________,理由是____________.
②气体____________,理由是____________.
③气体____________,理由是____________.
④气体____________,理由是____________.
参考答案:(1)NO (2)①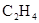 装置中没有温度计,无法控制反应温度
装置中没有温度计,无法控制反应温度
②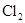 反应生成的
反应生成的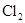 被C中的NaOH溶液吸收了.
被C中的NaOH溶液吸收了.
③ 反应生成的
反应生成的 被C中的
被C中的 吸收了
吸收了
本题解析:(1)制取乙烯需要温度计控制温度170℃,所以根据装置图可判断,不能制得纯净的乙烯;氯气能被氢氧化钠溶液吸收,所以无法收集到氯气;氨气极易溶于水,如果用水,则生成的氨气被是完全吸收,得不到氨气,所以只能制取的是NO。
本题难度:一般
3、填空题 下列各组气体中,在通常状况下能共存,并且都能用浓硫酸干燥的是
A.SO2、H2S、Cl2
B.SO2、O2、NH3
C.SO2、CO2、O2
D.HCl、H2S、HI
参考答案:C
本题解析:A中三者不能共存(因:SO2+2H2S=3S+2H2O H2S+Cl2=S+2HCl),且H2S不能用浓硫酸干燥(因H2S具还原性,浓硫酸有强氧化性,所以H2S能被浓硫酸氧化);
B中SO2、NH3不能共存(因两者能发生反应),NH3不能用浓硫酸干燥(因2NH3+H2SO4=(NH4)2SO4);
D中三者能共存,但H2S、HI不能用浓硫酸干燥(原因同A,发生氧化还原反应);
本题难度:一般
4、实验题 从海水或盐湖水直接制盐,只能得到粗盐,其中含有不溶性的泥沙和CaCl2、
MgCl2、Na2SO4等杂质。要得到纯净的NaCl还需要除去其中的杂质。
(1)取适量粗盐样品,加水溶解后再过滤,目的是:?
(2)检验滤液中含有SO42—的方法是:?
(3)为了除去NaCl溶液中的可溶性杂质,还需要向溶液中依次加入下列化学试剂:
①BaCl2溶液;②NaOH溶液;③Na2CO3溶液。反应的方程式依次为:
?
?
?
?
(4)反应完成后,还应该这样操作才能得到纯净的NaCl溶液?
?
(5)最后从NaCl溶液中提取出NaCl固体,采用的实验方法是?;该实验
要用到的玻璃仪器有:?。
参考答案:(1)除去氯化钠中不溶性的泥沙?
(2)取少量滤液于试管中,向其中加入稀盐酸,无沉淀生成,再加入BaCl2
溶液,有白色沉淀生成,则证明滤液中含有SO42—
(3)BaCl2+Na2SO4=BaSO4↓+2NaCl
MgCl2+2NaOH=Mg(OH)2↓+2NaCl
BaCl2+Na2CO3=BaCO3↓+2NaCl
CaCl2+Na2CO3=CaCO3↓+2NaCl
(4)将溶液过滤后,向滤液中加入适量稀HCl
(5)蒸发;?酒精灯、玻璃棒
本题解析:(2)检验SO42—的方法为取少量滤液于试管中,向其中加入稀盐酸,无沉淀生成,再加入BaCl2
溶液,有白色沉淀生成,则证明滤液中含有SO42—
(4)反应完成后,溶液中还有多余的碳酸根,故要加入稀硫酸。
(5)从溶液中提取溶质的做法一般是蒸发,使用的玻璃仪器有酒精灯、玻璃棒。
点评:此题考核了粗盐提纯过程中涉及的步骤,注意在选用除杂试剂时,最好选择那些不会代入杂质的试剂,此题难度不大。
本题难度:一般
5、填空题 在已经提取氯化钠、溴、镁等化学物质的富碘卤水中,采用下面的工艺流程生产单质碘:
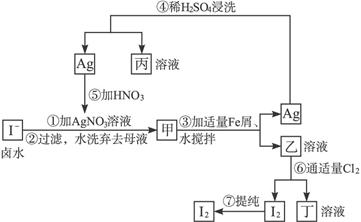
试完成下列问题:
(1)乙、丁中溶质的化学式:乙____________;丁____________。
(2)第④步操作中用稀H2SO4浸洗的目的是____________(填写字母编号)。
a.除去未反应的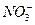 ? b.除去未反应的I-
? b.除去未反应的I-
c.除去未反应的Fe? d.除去碱性物质
(3)第⑦步操作可供提纯I2的一种方法是____________(不要求写具体步骤)。
(4)实验室检验I2的方法是________________________。
(5)甲物质见光易变黑,其原因是______________________________(用化学方程式表示)。
参考答案:(1)FeI2? FeCl3? (2)c? (3)升华或萃取? (4)将I2加到淀粉溶液中,溶液显蓝色?(5)2AgI 2Ag+I2
2Ag+I2
本题解析:富碘卤水中的I-与Ag+反应生成AgI(甲),AgI、铁粉在水中经不断搅拌,会缓慢发生反应,生成Ag和FeI2(即物质乙),在第④步加入稀H2SO4是溶解多余的铁粉而提纯银,再把银溶于硝酸,制取AgNO3,重新与I-反应。而乙溶液中通入适量Cl2,可生成FeCl3溶液(丁)和I2单质,用升华或萃取的办法提纯碘。
点评:本题考查了卤素及其化合物的特性、X-(卤离子)的检验等知识,考查了学生综合运用知识的能力。
可运用平衡移动的观点解释AgI、铁粉在水中的反应:AgI(s) Ag++I-,加入Fe粉2Ag++Fe====2Ag+Fe2+,使AgI的溶解平衡正向移动,AgI逐渐溶解生成FeI2和Ag。
Ag++I-,加入Fe粉2Ag++Fe====2Ag+Fe2+,使AgI的溶解平衡正向移动,AgI逐渐溶解生成FeI2和Ag。
本题难度:简单