微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在日常生活中,与化学反应速度有关的做法是( )
A.用热水溶解蔗糖以加速溶解
B.把块状煤碾成粉末状再燃烧
C.真空包装食品,以延长保质期
D.低温冷藏使食品延缓变质
参考答案:A、温度升高加速蔗糖分子的运动,使蔗糖溶解加速,但蔗糖溶解属于物理变化,不是化学变化,故A错误;
B、把块状煤碾成粉末状,增大与氧气的接触面积,加快煤的燃烧,故B正确;
C、真空包装隔绝氧气,抑制微生物的繁殖,延缓食品变质,保质期长,故C正确;
D、采用冷藏的方法储存食品时,温度低,微粒的运动速率慢,食品缓慢氧化的速率慢,保质期就长,故D正确;
故选BCD.
本题解析:
本题难度:简单
2、填空题 把在空气中久置的铝片 5.0g投入盛有500?mL0.5mol/L硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间的关系可用下图所示的坐标曲线来表示。请回答下列问题
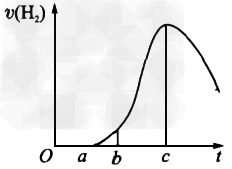
(1)曲线由O→a段不产生氢气的原因是_______________。有关反应的化学方程式为_________________________。 ?
(2)曲线由a→c段,产生氢气的速率增加较快的主要原因是______________。?
(3)曲线由c以后,产生氢气的速率逐渐下降的主要原因是________________。
参考答案:(1)硫酸首先和氧化铝反应,不产生氢气;Al2O3+3H2SO4=Al2(SO4)3+3H2O?
(2)a→c段,反应放热,温度升高,使反应速率增大?
(3)曲线c以后,硫酸的浓度逐渐变小,该因素变为影响反应速率的主要因素,使反应速率减小
本题解析:
本题难度:一般
3、实验题 化学反应速率的变化和化学平衡移动的规律都可以通过实验得出结论,勒夏特列原理也是由实验总结出来的。
(1)将铜片投入到稀硝酸中,开始时产生气泡的速率很慢,随后反 应速率增大,根据你学到的知识分析,反应速率增大的原因是________________ __________________。当进行一段时间后,反应速率又减慢,这次速率减慢的原因是_______________________________。
应速率增大,根据你学到的知识分析,反应速率增大的原因是________________ __________________。当进行一段时间后,反应速率又减慢,这次速率减慢的原因是_______________________________。
(2)丙酮和碘在酸性溶液中发生下列反应:CH3COCH3+I2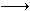 CH3COCH2I+H++I-。25℃时,该反应的速率由下列经验公式决定:
CH3COCH2I+H++I-。25℃时,该反应的速率由下列经验公式决定:
υ=k?c(CH3COCH3)?c(H+)[mol/(L?s)]
根据该经验公式,如果c(I2),c(CH3COCH3),c(H+)的起始浓度依次为0.01 mol/L,0.1 mol/L,0.01 mol/L,分析反应速率的变化趋势是_______________ ________________。
(3)在一支试管中先加入30 mL 0.01 mol/L FeCl3溶液,再滴加10 mL 0.01 mol/L KSCN溶液,摇匀。将制得的溶液平均分装于4支试管中,然后分别加入:①FeCl3固体;②KSCN固体;③KCl固体;④H2O。充分振荡后,溶液的颜色基本不变的是________(填序号)。
(4)在50 mL的注射器中吸入40 mL NO2和N2O4的混合气体,在另一同样规格的注射器中吸入40 mL Br2(g),对比两注射器中气体的颜色完全一致。然后都将注射器的活塞慢慢推至20 mL处,发现注射器内气体的颜色变化的现象是___________________________。推测平衡移动是通过观察装入NO2和N2O4的混合气体的注射器内气体的颜色比装入Br2(g)的注射器内气体的颜色_______。
(5)如果要鉴别密封于由两球连通的密闭容器中充满的红棕色气体是NO2和N2O4混合气还是Br2(g),可以____________________。
参考答案:(1)该反应是放热反应(1分)。随着反应的进行,硝酸的浓度减小(1分)。
(2)先逐渐增大后逐渐减小?(2分)。
(3)③?(2分)。
(4)前者先变深后变浅,但比原来深;后者只变深?(2分)。?浅?(2分)。
(5)通过加热(其他合理答案也可)?(2分)。
本题解析:略
本题难度:一般
4、实验题 (7分)过氧化氢对环境友好,性质多样,有很重要的研究和应用价值。
实验室利用反应2H2O2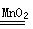 2H2O+O2↑可制备氧气。① 取等物质的量浓度等体积H2O2溶液分别进行下列实验,研究外界条件对该反应速率的影响,实验报告如下表所示。
2H2O+O2↑可制备氧气。① 取等物质的量浓度等体积H2O2溶液分别进行下列实验,研究外界条件对该反应速率的影响,实验报告如下表所示。
序号
| 条件
| 现象
| 结论
|
温度/℃
| 催化剂
|
1
| 40
| FeCl3溶液
|
|
|
2
| 20
| FeCl3溶液
|
|
|
3
| 20
| MnO2
|
|
|
4
| 20
| 无
|
|
|
实验1、2研究的是 对H2O2分解速率的影响。
实验2、3的目的是
实验中可以表明该反应速率差异的现象是
② 实验室用MnO2做该反应的催化剂,使用如右图所示装置的A部分制备O2,避免反应过于剧烈的操作是 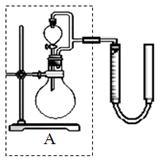
参考答案:(7分).①温度(1分) 比较FeCl3溶液和MnO2作为催化剂对H2O2分解反应速率影响的差异 产生气泡的快慢 ② 旋转分液漏斗的活塞,控制滴加H2O2溶液的速率 (除注明外每空2分)
本题解析:①根据表中数据可知,实验1和2中不同的是温度,所以实验1、2研究的是温度对H2O2分解速率的影响;实验2、3中不同的是催化剂,所以其实验的目的是比较FeCl3溶液和MnO2作为催化剂对H2O2分解反应速率影响的差异。
②避免反应过于剧烈方法是控制加入双氧水的速率,所以正确的操作是旋转分液漏斗的活塞,控制滴加H2O2溶液的速率。
考点:考查外界条件对反应速率的影响
点评:在判断或验证外界条件对反应速率的影响时,需要注意的是,不能同时改变2个或多个条件,否则无法验证或判断。应该是在其它条件不变的情况下,逐步改变进行验证。同时还需要设计对比实验,以保证实验的科学性和准确性。
本题难度:一般
5、选择题 设C+CO2 2CO(正反应吸热),正反应的反应速率为v1;N2+3H2
2CO(正反应吸热),正反应的反应速率为v1;N2+3H2 2NH3(正反应放热),正反应的反应速率为v2。对于上述反应,当温度升高时,v1和v2的变化情况为
2NH3(正反应放热),正反应的反应速率为v2。对于上述反应,当温度升高时,v1和v2的变化情况为
A.v1减小,v2增大
B.同时减小
C.v1增大,v2减小
D.同时增大
参考答案:D
本题解析:温度升高会使反应速率增大。
本题难度:一般