微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 等质量的两种气体SO2和SO3,其物质的量之比为?,二者所含O原子个数之比为?,在同温同压下的体积之比为?。
参考答案:5:4 ;5:6 ;5:4
本题解析:根据n=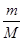 =
=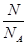 =
=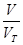 解:设SO2与SO3均为1g,则n(SO2):n(SO3)=
解:设SO2与SO3均为1g,则n(SO2):n(SO3)=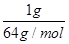 :
: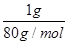 =5:4;则SO2中n(O)=2n(SO2)=2×
=5:4;则SO2中n(O)=2n(SO2)=2×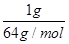 ,SO3中n(O)="3" n(SO3)=3×
,SO3中n(O)="3" n(SO3)=3×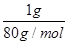 ,则氧原子个数比为5:6;据阿伏加德罗定律,体积之比等于物质的量之比,即V(SO2):V(SO3)= n(SO2):n(SO3)=5:4。
,则氧原子个数比为5:6;据阿伏加德罗定律,体积之比等于物质的量之比,即V(SO2):V(SO3)= n(SO2):n(SO3)=5:4。
本题难度:一般
2、选择题 PM2.5是指直径小于等于2.5 是悬浮颗粒物,其主要来源为燃煤、机动车尾气等。某实验小组将PM2.5样本用蒸馏水处理制成待测试样。测得该试样呈酸性,其各离子浓度如下表,根据表中数据可知该溶液PH为
是悬浮颗粒物,其主要来源为燃煤、机动车尾气等。某实验小组将PM2.5样本用蒸馏水处理制成待测试样。测得该试样呈酸性,其各离子浓度如下表,根据表中数据可知该溶液PH为
离子
| K+
| Na+
| NH4十
| 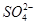
| 
| C1—
|
浓度/mol.L—1
| 4×l0—6
| 6×l0—6
| 2×l0—5
| 4×l0—5
| 3×l0—5
| 2×l0—5
|
A.2 B.4 C.1 D.6
参考答案:B
本题解析:根据电荷守恒,c(H+)= [c(Cl-)+c(NO3-)+2c(SO42-)]-[c(K+)+c(Na+)+c(NH4+)]=l0—4mol.L—1,pH=4
考点:考查溶液中离子浓度的计算有关问题。
本题难度:一般
3、计算题
海洋约占地球表面积的71%,具有十分巨大的开发潜力。某校研究性学习小组同学对经初步净化处理的浓缩海水(主要含NaCl和MgSO4)进行研究。
(1)实验时,若配制1000 mL 0.20 mol/L NaOH溶液,计算称量固体NaOH的质量。
(2)取初步净化处理的浓缩海水100 mL,加入200 mL 0.20 mol/L NaOH溶液,恰好将其中的Mg2+完全沉淀,求浓缩海水中Mg2+的物质的量浓度。
(3)研究小组同学把上述沉淀完全转化为无水MgCl2,并在熔融状态下进行电解(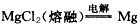 +Cl2) ,可得标准状况下Cl2多少升?
+Cl2) ,可得标准状况下Cl2多少升?
参考答案:(1) m(NaOH)=0.20mol/L×1L×40g/mol=8g
(2)MgCl2+2NaOH=Mg(OH)2↓+2NaCl

(3)
V(Cl2)=0.2mol/L×0.1L×22.4L/mol=0. 448L
本题解析:
本题难度:一般
4、选择题 下列说法错误的是( )
A.从1L1mol?L-1的氯化钠溶液中取出10ml,其浓度仍是1mol?L-1
B.物质的量是指物质所含微粒的数目
C.0.5L2mol?L-1的氯化钡溶液中,钡离子和氯离子总数为3×6.02×1023
D.冰水混合物既是纯净物又是化合物
参考答案:A.溶液具有均匀性,同一溶液浓度相同,与溶液体积无关,所以从1L1mol?L-1的氯化钠溶液中取出10ml,其浓度仍是1mol?L-1,故A正确;
B.物质的量是一定数目粒子的集合体,不是粒子的数目,故B错误;
C.氯化钡的物质的量=2mol/L×0.5L=1mol,一个氯化钡化学式中含有2个氯离子和1个钡离子,所以0.5L2mol?L-1的氯化钡溶液中,钡离子和氯离子总数为3×6.02×1023,故C正确;
D.冰水只是状态不同,但是同一种物质,所以冰水混合物是纯净物,冰水都是含有两种元素的纯净物,所以都属于化合物,故D正确;
故选B.
本题解析:
本题难度:一般
5、填空题 (3分)将足量BaCO3分别加入:① 30mL 水 ②10mL 0.2mol/LNa2CO3溶液 ③50mL 0.01mol/L 氯化钡溶液 ④100mL 0.01mol/L盐酸中溶解至溶液饱和。请确定各溶液中Ba2+的浓度由大到小的顺序为: _____
参考答案:
本题解析:
① 30mL 水,BaCO3正常电离② 0.2mol·L-1Na2CO3溶液,BaCO3电离程度变小,③50mL 0.01mol/L 氯化钡溶液,BaCO3电离程度变小,但比Ba2+ 浓度大,比0.01mol/L略大;④100mL 0.01mol/L盐酸中溶解至溶液饱和,Ba2+ 约是0.005mol/L。Ba2+ 的顺序为③④①②。
本题难度:一般