微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在NaCl、MgCl2、MgSO4形成的混合溶液中,c(Na+)=0.10mol?L-1,c(Mg2+)=0.25mol?L-1,c(Cl-)=0.20mol?L-1,则c(SO42-)为
A.0.15mol?L-1
B.0.10mol?L-1
C.0.25mol?L-1
D.0.20mol?L-1
参考答案:D
本题解析:分析:令硫酸根的物质的量浓度为c,根据溶液中阴阳离子所带的正负电荷总数相等,列式计算c值.据此判断.
解答:令硫酸根的物质的量浓度为c,根据溶液中阴阳离子所带的正负电荷总数相等,则:
0.10mol?L-1×1+0.25mol?L-1×2=0.20mol?L-1×1+2c
解得:c=0.2mol/L.
故选:D.
点评:考查溶液物质的量浓度的计算,难度不大,利用常规解法,比较麻烦,本题根据溶液不显电性阳离子与阴离子所带电荷总数相等,即电荷守恒原则解答,注意电荷守恒原则在混合溶液有关离子浓度计算经常运用.
本题难度:一般
2、填空题 实验室制得的乙炔中常混有H2S、PH3等杂质气体。如图是两学生设计的实验装置,用来测定CaC2样品的纯度,右边的反应装置相同而左边的气体发生装置则不同,分别如Ⅰ和Ⅱ所示。
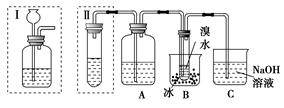
(1)A瓶中的液体可以从酸性KMnO4溶液和FeCl3溶液中选择,应该选择________,它的作用是___________________________。
(2)装置Ⅰ的主要缺点是______________________________________。
(3)装置Ⅱ的主要缺点是_____________________;
若选用此装置来完成实验,则应采取的措施是___________________。
(4)若称取a g CaC2,反应完全后,测得B处溴水增重b g,则CaC2的纯度为________。
参考答案:(1)FeCl3溶液 除去H2S、PH3等杂质气体
(2)部分乙炔会从长颈漏斗逸出,造成实验误差,且不易控制加水量
(3)反应产生的泡沫易堵塞导管 在装置的导管口加上一团棉花
(4)  ×100%
×100%
本题解析:A瓶中的液体是用来除去混在乙炔中的H2S、PH3,酸性KMnO4溶液会在除去H2S、PH3的同时也将C2H2氧化,故选用FeCl3溶液,装置Ⅰ和Ⅱ均可制乙炔,但装置Ⅰ的主要缺点为部分乙炔气体会从长颈漏斗口逸出,造成实验误差,且长颈漏斗也不易控制加水量。由于CaC2与水剧烈反应产生泡沫,故装置Ⅱ的缺点为泡沫易堵塞导管,可在装置的导管口加上一团棉花。实验时,B处溴水增加质量即为所吸收乙炔的质量,由题意则有:n(CaC2)=n(C2H2)= mol,m(CaC2)=
mol,m(CaC2)= mol×64 g/mol=
mol×64 g/mol= g,CaC2的纯度=
g,CaC2的纯度= ×100%。
×100%。
本题难度:一般
3、选择题 下列说法中正确的是
A.久置的浓HNO3呈黄色,为除去黄色可通入O2
B.NH4Cl4固体中混有I2,可用加热的方法除去
C.为除去FeSO4溶液中的Fe2(SO4)3可加入Cu 粉
D.为除去SO2中少量的CO2,可使其通过澄清石灰水
参考答案:A
本题解析:选项A,久置的浓HNO3呈黄色,是由于发生了如下反应:4HNO3 4NO2+O2+2H2O,通入O2能使溶解在HNO3溶液中的NO2转化为HNO3。选项B,加热时NH4Cl要分解,故不能通过加热方法除去I2。选项C,Fe2(SO4)3与Cu反应生成新的CuSO4杂质,应加入过量Fe粉充分反应后过滤来除去Fe2(SO4)3。选项D,SO2、CO2均被澄清石灰水吸收。
本题难度:一般
4、选择题 可以用分液漏斗进行分离的混合物是( )
A.酒精和碘水
B.苯和水
C.乙酸和乙酸乙酯
D.乙酸和水
参考答案:B
本题解析:
本题难度:简单
5、填空题 (6分)如图为实验室分离水和乙醇的装置图,根据图示回答下列问题。
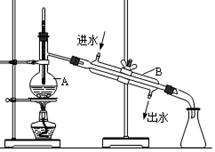
(1) 图中的两处明显的错误是:
_________________________________,
_________________________________。
(2) A仪器的名称是____________,B仪器 
的名称是_______________。
(3) 实验时向A中加入少量碎瓷片的作用是:
____________________________________________________。
(4)实验后锥形瓶中所收集到的物质为____________。
参考答案:(1) 进水口、出水口的位置;温度计水银球的位置。
(2) 蒸馏烧瓶;冷凝管。? (3) 防止暴沸。? (4) 乙醇。? (各1分)
本题解析:略
本题难度:简单