微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)有一包从海水中获得的粗盐,已经经过初步的提纯。课外活动小组对它的成分进行探究,并将粗盐进一步提纯。
探究一:这包粗盐中还含有什么杂质?
根据海水的成分和初步提纯的实验操作,估计该粗盐可能还含有的杂质是CaCl2和MgCl2。现用实验验证这种推测:取样并溶解,加入数滴NaOH溶液,目的是检验是否会有?(填化学式,下同);接着再加入数滴Na2CO3溶液,目的是检验是否会有?。实验证明这包粗盐含有的杂质是CaCl2 。
。
探究二:这包粗盐中NaCl的质量分数是多少?
按下面步骤进行实验:①称取一定质量的样品; ②将样品加水溶解,制成粗盐溶液;③向粗盐溶液中加入过量的某种试剂,过滤;④沉淀洗涤后小心烘干,得到纯净固体A;⑤溶液在进行某一操作后,移入蒸发皿蒸发,得到纯净固体B;⑥称量实验中得到的某种固体。
②将样品加水溶解,制成粗盐溶液;③向粗盐溶液中加入过量的某种试剂,过滤;④沉淀洗涤后小心烘干,得到纯净固体A;⑤溶液在进行某一操作后,移入蒸发皿蒸发,得到纯净固体B;⑥称量实验中得到的某种固体。
(1)②、③、⑤的步骤中,都使用到同一仪器?(填名称),它在步骤②和⑤中的操 作方法相同,但目的不同。在步骤②中的目是?,在步骤⑤中的目的是?。
作方法相同,但目的不同。在步骤②中的目是?,在步骤⑤中的目的是?。
(2)步骤③中加入的试剂是?(写化学式);步骤⑤中进行的“某一操作”是?,目的是?。
(3)步骤⑥中你认为需要称量的固体A 还是固体B,?(填A或B),你不选择另一种固体的理由是??。
还是固体B,?(填A或B),你不选择另一种固体的理由是??。
参考答案:探究一:? MgCl2?,? CaCl2?
探究二:(1)?玻璃棒?,?加快溶解?,?防止液滴溅出 ?
(2)Na2CO3,逐滴滴入稀盐酸,直至不再产生气泡为止,?,?除去过量Na2CO3?
(3)?A ?, 蒸发所得的氯化钠中,有一部分是碳酸钠除氯化钙时生成的,还有一部分是过量的碳酸钠与盐酸反应得到的,不能用于计算
本题解析:略
本题难度:一般
2、选择题 下列对实验现象的解释与结论正确的是
编号
| 实验操作
| 实验现象
| 解释与结论
|
A
| 向某溶液中加入BaCl2溶液
| 有白色沉淀产生
| 生成了难溶于水的BaSO4,
该溶液中一定含有SO42-
|
B
| 向鸡蛋清溶液中,
加入饱和(NH4)2SO4溶液
| 有白色沉淀产生
| 蛋白质发生了盐析
|
C
| 向甲苯中滴入少量浓溴水,
振荡,静置
| 溶液分层,上层呈橙红色,下层几乎无色
| 甲苯和溴水发生取代反应,
使溴水褪色
|
D
| 向蔗糖中加入浓硫酸
| 变黑,放热,体积膨胀,放出刺激性气体
| 浓硫酸具有吸水性和强氧化性,
反应中生成C、SO2和CO2等
参考答案:B
本题解析:A项AgNO3等产生同样现象,故A错;C项中甲苯使溴水褪色是萃取;向蔗糖中加入浓硫酸变黑,体现浓硫酸的脱水性,D错。
本题难度:一般
3、选择题 下列有关实验的说法中错误的是
[? ]
A.在蒸馏的实验中,温度计的水银球位于支管口处是为了测出馏分的沸点
B.用直接蒸馏的方法可以得到无水乙醇
C.在重结晶的实验中,使用短颈漏斗趁热过滤是为了减少被提纯物质的损失
D.作为重结晶实验的溶剂,杂质在此溶剂中的溶解度受温度影响应该很大
参考答案:BD
本题解析:
本题难度:一般
4、实验题 人造金刚石酸洗废液中含有大量的Ni2+、Mn2+、Co2+离子,不经处理排放危害极大。某工厂技术人员设计了创新方案,使有害离子的浓度降低到排放标准,同时得到了纯度较高的镍粉。
废液经分析组成如下:

在强酸性的废液中加入NaOH调节pH到2,在搅拌下加入饱和Na2CO3溶液和NaClO除去Mn2+、Co2+,并控制pH不超过3.5(Na2CO3需缓慢加入,防止产生大量CO2而冒槽),过滤后电解含Ni2+的过滤液,以镍铬钛不锈钢片为阴极,以铅片为阳极,电解后在阴极得到镍粉。回答下列问题
⑴ 调节强酸性废液至pH=2,可否直接用饱和Na2CO3溶液?分析你的原因
⑵ 写出除去废液中Mn2+、Co2+的反应方程式
⑶ 搅拌过程中Ni不被沉淀下来,实际操作中是如何实现?
⑷ 电解过程中电流效率与pH的关系如下图,试分析如下图所示变化的原因.并选择电解的最佳pH值
参考答案:⑴ 不可以,将产生大量CO2而冒槽?(1分)
⑵ 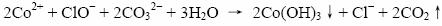
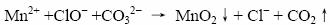 ?(2分) ?(2分)
⑶ 根据废液离子浓度分析结果,控制NaClO用量,可使Mn2+,Co2+沉淀完而Ni2+不被沉淀。(1分)
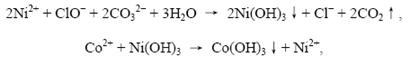
⑷ pH较低时,将产生大量氢气,电流效率低;pH>4.5时,将产生Ni(OH)2沉淀,Ni2+浓度下降,不利于Ni的析出。(2分)选择在4.0-4.5左右?(1分)
本题解析:⑴认真阅读试题可从题中获得相关信息,当溶液酸性太强时,直接加入饱和Na2CO3溶液会产生大量的CO2,从而发生冒槽。
⑵Mn2+、Co2+在碱性增强的条件下,被ClO-氧化并生成沉淀,通过过滤的方法可以除去这两种杂质离子——这是溶液中除杂最常用的方法之一,如Fe2+的除杂。
Mn2+在碱性条件下,被氧化为+4,以MnO2的形式被除去,离子方程式为:
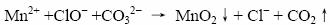
Co2+在碱性条件下不稳定,生成Co(Ⅲ)的氢氧化物,离子方程式如下:
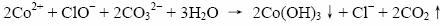
在书写离子方程式的时候,也应该结合题意,溶液由于pH<3.5,仍为酸性条件,所以CO32-结合H+,生成CO2气体。
⑶Ni(Ⅲ)和Co(Ⅲ)都有很强的氧化性,但Ni(Ⅲ)非常不稳定,氧化性比Co(Ⅲ)化合物的氧化性强,因此只要ClO-适量,即使Ni2+被氧化生成了三价镍的化合物,也会被未参加反应的Co2+、Mn2+还原为Ni2+。因此防止Ni2+被沉淀的方法就是控制ClO-的用量。
⑷从图中曲线变化趋势可以看出,当溶液酸性较大时,电解效率很低,随着pH的增大,电解效率增大,但是当pH>4.5后,电解率与溶液pH变化不明显。因此此处要重点分析pH较小时电解效率不高,以及pH较大时电解效率也不高的原因。
由于H+、Ni2+都能在电极的阴极放电,所以当pH较小,也即[H+]较大时,将产生大量的氢气,造成电解效率较低。当pH较大时,由于Ni2+生成了难溶物,溶液中[Ni2+]减小,也造成电解效率低。因此,从图中可以看出来,最佳的pH范围大约为4.0~4.5。
本题难度:一般
5、选择题 下列除去杂质的方法正确的是( )
A.除去N2中的O2:通过灼热的CuO粉末,收集气体
B.除去Cl2中的少量HCl:通过饱和NaCl溶液,收集气体
C.除去FeCl2溶液中的少量FeCl3:加入足量铁屑,充分反应后过滤
D.除去KCl溶液中的少量MgCl2:加入适量NaOH溶液过滤
参考答案:A.CuO与氧气不反应,应通过灼热的铜网,故A错误;
B.氯气难溶于饱和食盐水,可用饱和食盐水除杂,故B正确;
C.FeCl3与铁反应生成FeCl2,能将杂质除去且不引入新杂质,故C正确;
D.加入MgCl2,生成NaCl杂质,故D错误.
故选BC.
本题解析:
本题难度:简单
|