微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将标准状况下的2.24 L CO2通入150 mL 1mol / LNaOH溶液中,下列说法正确的是
A.c(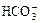 )略大于c(
)略大于c( )
)
B.该溶液只能与酸反应,不能与碱反应
C.c(Na+)等于c( )与c(
)与c(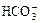 )之和
)之和
D.c(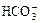 )略小于c(
)略小于c( )
)
参考答案:A
本题解析:略
本题难度:一般
2、选择题 某化学兴趣小组同学探索某些溶液的酸碱性。25℃时他们分别测得CH3COOH和(NH4)2SO4?两种溶液的pH都为4,并对结果作了以下四种分析。则其中正确的是
A.(NH4)2SO4?溶液呈酸性,是因为NH4+电离出H+
B.因为醋酸是弱酸,所以醋酸溶液中水的电离平衡被促进了
C.CH3COOH和(NH4)2SO4?溶液中水的电离出来的H+的物质的量浓度相同
D.CH3COOH和(NH4)2SO4?两水溶液呈酸性的原因不同
参考答案:D
本题解析:略
本题难度:一般
3、选择题 下列叙述中,不正确的是? ( )。
A.c(NH4+)相等的(NH4)2SO4和NH4Cl溶液中,溶质浓度大小关系:c[(NH4)2SO4]<c(NH4Cl)
B.向10 mL 0.10 mol·L-1的CH3COOH溶液中加入等物质的量的NaOH后,溶液中:c(Na+)=c(CH3COO-)>c(OH-)=c(H+)
C.两种不同浓度的HA溶液的物质的量浓度分别为c1和c2,pH分别为a和(a+1),则有c1≥10c2
D.NaHCO3溶液中:c(H+)+c(H2CO3)=c(CO32—)+c(OH-)
参考答案:B
本题解析:本题综合考查盐类水解、弱电解质的电离等,意在考查考生的综合思维能力。c(NH4+)相等的(NH4)2SO4和NH4Cl溶液中浓度较大的是NH4Cl,故A项正确;B项反应后的溶液中溶质为醋酸钠,因醋酸根水解使溶液呈碱性,故溶液中离子浓度:c(Na+)>c(CH3COO-)>c(OH-)>c(H+);C项,若HA为强酸,则c1=10c2,若HA为弱酸,c1>10c2;由物料守恒与电荷守恒可知D项正确。
本题难度:一般
4、选择题 物质的量浓度相等的4种溶液:①H2S、②NaHS、③Na2S、④H2S和NaHS的混合液。下列说法正确的是( )
A.溶液pH由大到小的顺序:③>②>①>④
B.c(H2S)由大到小的顺序:①>④>②>③
C.在Na2S溶液中:2c(Na+)=c(H2S)+c(HS-)+c(S2-)
D.在NaHS溶液中:c(H+)+c(Na+)=c(OH-)+c(HS-)+c(S2-)
参考答案:C
本题解析:选项A,NaHS、Na2S溶液中有HS-、S2-的水解,使其溶液均呈碱性,但S2-的水解能力大于HS-,故溶液的pH:③>②。H2S溶液呈酸性,H2S和NaHS的混合液中,由于HS-抑制H2S的电离,故溶液的pH:④>①,4种溶液的pH大小顺序为③>②>④>①。选项B,由于HS-抑制H2S的电离,所以H2S溶液中的c(H2S)小于H2S和NaHS的混合液中的c(H2S)。选项C,假设c(Na+)=0.1 mol·L-1,根据物料守恒有:c(H2S)+c(HS-)+c(S2-)=0.2 mol·L-1,故2c(Na+)=c(H2S)+c(HS-)+c(S2-)。选项D,根据电荷守恒有c(H+)+c(Na+)=c(OH-)+c(HS-)+2c(S2-)。
本题难度:一般
5、选择题 为了除去氯化镁酸性溶液中的Fe3+,可在加热搅拌的条件下加入一种过量的试剂,过
滤后再加入适量的盐酸。这种试剂是
A.氨水
B.氢氧化钠
C.碳酸镁
D.碳酸钠
参考答案:C
本题解析:除杂的原则是“不增、不减”。即不增加新的杂质,不减少被提纯的物质本身。由于是除去氯化镁酸性溶液中的Fe3+,可在加热搅拌的条件下加入一种过量的含有Mg元素的物质,既能反应消耗酸,使溶液的PH增大,以除去杂质Fe3+,也不添加新的杂质。分析各个选项,只有C. 碳酸镁符合要求。
本题难度:一般