微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 广义的水解观认为:无论是盐的水解还是非盐的水解,其最终结果是反应物中各物质和水分别解离成两部分,根据正负电荷相互吸引,两两重新组合成新的物质。根据上述信息,下列说法不正确的是( )
A.K2O2的水解产物是KOH和H2O2
B.PCl3的水解产物是HClO和PH3
C.NaClO的水解产物之一是HClO
D.CaC2的水解产物之一是C2H2气体
参考答案:B
本题解析:A中过氧化钾是由K+和O22-构成的,所以根据已知的信息可知,A正确;B不正确,氯元素的非金属性强于P的,所以生成物应该是HCl和H3PO3;同样分析可知,选项C和D是正确的,答案选B。
点评:该题是中等难度的试题,属于选项给予题,难度较大。试题侧重考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的知识迁移能力和发散思维能力,有利于提高学生的应试能力。
本题难度:一般
2、选择题 在一定浓度的FeCl3溶液中,存在如下水解平衡:Fe3++3H2O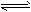 Fe(OH)3+3H+,在此溶液中滴入饱和的FeCl3溶液,下列哪个变化的说法正确
Fe(OH)3+3H+,在此溶液中滴入饱和的FeCl3溶液,下列哪个变化的说法正确
[? ]
A.水解平衡向正反应方向移动
B.水解平衡向逆反应方向移动
C.溶液中H+浓度增大
D.Fe3+的水解程度增大
参考答案:AC
本题解析:
本题难度:一般
3、选择题 等体积、等物质的量浓度的NaCl和NaF溶液中,阴阳离子总数相比?(?)
A.前者多
B.后者多
C.一样多
D.无法判断
参考答案:B
本题解析:
正确答案:B
NaF是强碱弱酸盐,F++H2O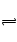 HF+OH― ,促进水电离。后者生成的OH―多,阴阳离子总数相比后者多。
HF+OH― ,促进水电离。后者生成的OH―多,阴阳离子总数相比后者多。
本题难度:简单
4、选择题 已知KHSO3溶液呈弱酸性。在0.1mol·L-1KHSO3溶液中,下列关系正确的是
A.c(K+)+ c(H+) =c(HSO3-)+ c(OH-)+ c(SO32-)
B.c(HSO3-) + c(SO32-) = 0.1mol·L-1
C.c(SO32-) < c(H2SO3)
D.c(K+) = c(H2SO3) + c(HSO3-) + c(SO32-)
参考答案:D
本题解析:在0.1mol·L-1KHSO3溶液中:A项根据电荷守恒:c(K+)+ c(H+)=c(HSO3-)+c(OH-)+2c(SO32-),故原等式不成立;B项根据S元素守恒:c(HSO3-)+ c(H2SO3) + c(SO32-) = 0.1mol·L-1,故原等式不成立;C项中因HSO3-显酸性,说明电离大于水解,故c(SO32-)>c(H2SO3),原关系错误;D项根据物料守恒:c(K+) = c(H2SO3) + c(HSO3-) + c(SO32-),正确。3溶液中离子浓度的关系的正确性判断。
本题难度:一般
5、填空题 下图为常温下向25mL 0.1 mol·L-1 MOH溶液中逐滴滴加0.2 mol·L-1HA溶液过程中溶液pH的变化曲线。
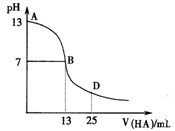
回答下列问题:
(1)上图能确定MOH为?(“强”或“弱”)碱,
理由是?。
(2)上图能确定HA为?(“强”或“弱”)酸,
理由是?。
(3)在D点时,溶液中c(A-)+c(HA)?2c(M+)。(填“>”、“<”或“=”)
参考答案:(1)强(2分);常温条件下水的离子积常数为10-14,0.1 mol·L-1 MOH溶液的pH=13,说明为强碱。(3分)
(2)弱(2分);若HA为强酸则在pH=7是刚好完全反应,体积消耗HA12.5mL,而现在是13ml,说明生成的强碱弱酸盐。(3分)
(3)=(3分)
本题解析:略
本题难度:一般