微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 氯离子插层镁铝水滑石[Mg2Al(OH)6Cl?xH2O]是一种新型离子交换材料,其在高温下完全分解为MgO、 Al2O3、HCl和水蒸气,现用如图装置进行实验确定其化学式(固定装置略去)。

(1)Mg2Al(OH)6Cl?xH2O热分解的化学方程式为?。
(2)若只通过测定装置C、D的增重来确定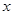 ,则装置的连接顺序为?(按气流方向,用接口字母表示),其中C的作用是?。装置连接后,首先要进行的操作名称是?。
,则装置的连接顺序为?(按气流方向,用接口字母表示),其中C的作用是?。装置连接后,首先要进行的操作名称是?。
(3)加热前先通过N2排尽装置中的空气,反应完成后,再持续通入N2的作用是?。
(4)完全分解后测得C增重3.65g、D增重9.90g,则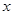 =?.
=?.
参考答案: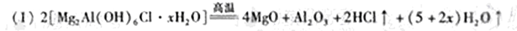
(2)a-c-d-b,吸收HCl气体,检查气密性
(3)将分解产生的气体全部带入装置C、D中完全吸收,防止倒吸
(4)3
本题解析:(1)根据题给信息:高温下完全分解为MgO、 Al2O3、HCl和水蒸气,可写出其化学方程式: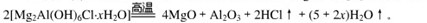
(2)装置C的作用是吸收反应生成的HCl气体,装置D的作用是吸收水蒸气,应该首先通过D装置吸收水蒸气,后通过C装置吸收HCl;将气体通过洗气瓶进行洗气时,应该从长导管一侧通入气体,故其连接顺序是a-c-d-b;连接好装置后首先应该检查装置的气密性。
(3)因为加热后的装置中含有残留的HCl和水蒸气,为了避免引起实验误差,保证反应产生的气体全部被装置C、D吸收,所以要通入N2排出装置内残留的气体,同时也是为了防止产生倒吸。
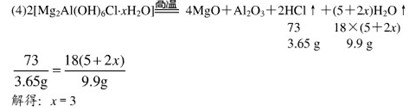
点评:本题考查化学方程式的书写,主要考查对实验装置和实验流程的理解和熟悉实验操作,同时通过计算,确定水分子数。综合性较强,题目难度较大。
本题难度:一般
2、简答题 海洋植物如海带、海藻中含有丰富的碘元素,碘元素以离子的形式存在.实验中从海藻提取碘的流程如图所示.
(1)指出提取碘的过程中有关的实验操作名称①______;写出过程②中有关反应的化学方程式______.
(2)提取碘的过程中可提供选择的有机试剂为______
A.酒精、四氯化碳B四氯化碳、苯C.汽油、醋酸D.汽油、甘油
(3)为使海藻灰中碘离子转化为碘的有机溶液,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品,尚缺少的玻璃仪器是______.
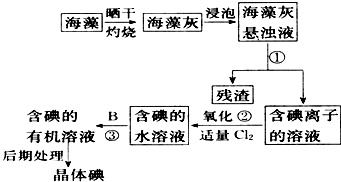
参考答案:(1)①为不溶性固体与溶液的分离,则为过滤操作,②为氯气与NaI的反应,该反应为2NaI+Cl2═2NaCl+I2,
故答案为:过滤;2NaI+Cl2═2NaCl+I2;
(2)萃取剂不能与水混溶,酒精、醋酸、甘油均不能作含碘溶液的萃取剂,故答案为:B;
(3)碘离子转化为碘的有机溶液,主要涉及灼烧、溶解过滤及分液、蒸馏等操作,过滤使用漏斗、烧杯、玻璃棒;分液需要分液漏斗等,缺少的仪器为过滤、分液漏斗,故答案为:过滤、分液漏斗.
本题解析:
本题难度:简单
3、实验题 工业上制硫酸的设备分为三大部分,一是沸腾炉、二是接触室、三是吸收塔。在沸腾炉内煅烧黄铁矿生成二氧化硫;在接触室内有催化剂存在下二氧化硫进一步与氧气结合,生成三氧化硫;三氧化硫流经吸收塔时,采用98.3% 的浓硫酸吸收,使三氧化硫最终与水化合形成硫酸。下面的装置是仿照工业上制备硫酸的工艺流程设计出来的,用于探究工业上为何采用98.3%的浓硫酸吸收三氧化硫。
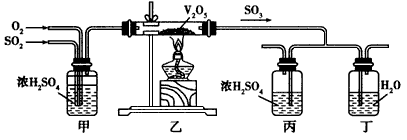
请回答下列问题:
(1)写出沸腾炉内煅烧黄铁矿的反应方程式______________________。
(2)上图中的乙、丙分别相当于工业上制取硫酸装置中的________________、_______________。
(3)丙中的现象为____________,丁中的现象为____________。
(4)下图是压强对SO2平衡转化率的影响
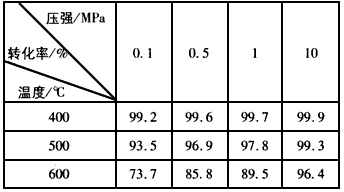
对SO2转化为SO3的反应,增大压强可使转化率____________,之所以通常采用常压操作是因为____________________________。
参考答案:(1)4FeS2+11O2 2Fe2O3+8SO2
2Fe2O3+8SO2
(2)接触室;吸收塔
(3)无酸雾;有酸雾
(4)增大;常压下SO2的转化率已很大
本题解析:
本题难度:一般
4、选择题 不能鉴别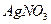 、
、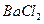 、
、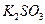 和
和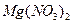 四种溶液(不考虑他们之间的相互反应)的试剂组是?(?)
四种溶液(不考虑他们之间的相互反应)的试剂组是?(?)
A.盐酸、硫酸
B. 盐酸、氢氧化钠溶液
盐酸、氢氧化钠溶液
C.氨水、硫酸
D.氨水、氢氧化钠溶液
参考答案:D
本题解析:略
本题难度:一般
5、实验题 (12分)某课外活动小组为了测定某氯化锶(SrCl2)样品的纯度,设计了如下方案:
称取1.0g样品溶解于适量水中,向其中加入含AgNO32.38g的AgNO3溶液(溶液中除Cl―外,不含其它与Ag+反应生成沉淀的离子),Cl―即被全部沉淀。然后用含Fe3+的溶液作指示剂,用0.2mol/L的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+以AgSCN白色沉淀的形式析出,以测定氯化锶样品的纯度。请回答下列问题:
(1)滴定反应达到终点的现象是?;
(2)实施滴定的溶液以呈?(选填“酸性”、“中性”或“碱性”)为宜,加
?(填化学式)试剂可达到这一目的;
(3)在终点到达之前的滴定过程中,两种沉淀表面会吸附部分Ag+,需不断剧烈摇动锥形瓶,否则会使n (Clˉ)的测定结果?(选填“偏高”、“偏低”或“无影响”);
(4)到达终点后,则必须轻轻摇动锥形瓶,(此时不得剧烈摇动)以减少误差,否则这种误差会使n (Clˉ)测定值偏低,这说明两者的溶解度:AgCl ??AgSCN(填“>”或“<”);
(5)若以Fe3+的溶液作指示剂,用NH4SCN标准溶液滴定剩余的AgNO3时,用去上述浓度的NH4SCN溶液20.0mL,则原氯化锶样品的纯度为?。
参考答案:(1)溶液由无色变为血红色?(2)酸性?HNO3
(3)偏高?(4)>?(5)79.5%
本题解析:(1)由于铁离子能和NH4SCN反应使溶液显红色,所以终点时的现象是溶液由无色变为血红色。
(2)由于在碱性溶液中铁离子和银离子易形成氢氧化物沉淀,所以溶液应该显酸性。由于不能引入杂质,所以易用硝酸酸化。
(3)沉淀表面会吸附部分Ag+,所以会导致查质量增加,从而导致测定结果偏高。
(4)这种误差会使n (Clˉ)测定值偏低,这说明沉淀会转化为AgSCN沉淀,因此氯化银的溶解度大于AgSCN的。
(5)消耗0.2mol/L的NH4SCN的物质的量是0.004mol,硝酸银是2.38g÷170g/mol=0.014mol,所以和氯离子反应的硝酸银是0.014mol-0.004mol=0.01mol,因此氯化锶的质量是0.005mol×156g/mol=0.795g,所以原氯化锶样品的纯度为79.5%。
本题难度:一般