微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 pH=5的盐酸和pH=9的氢氧化钠溶液以体积比11:9混合,则混合液的pH为
[? ]
A.7.2
B.8
C.6
D.无法计算
参考答案:C
本题解析:
本题难度:一般
2、简答题 常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合后所得溶液的pH如下表:
| 实验编号 | HA的浓度/(mol?L-1) | NaOH的浓度/(mol?L-1) | 混合溶液的pH
甲
0.2
0.2
pH=a
乙
c
0.2
pH=7
丙
0.1
0.1
pH>7
|
请回答:
(1)不考虑其他组的实验结果,仅从甲组情况分析,如何用a的大小来说明HA是强酸还是弱酸?.
(2)不考虑其他组的实验结果,仅从乙组情况分析,c是否一定等于0.2?(填“是”或“否”).混合溶液中离子浓度c(A-)与c(Na+)的大小关系是?(填序号).
A.前者大?B.后者大?C.二者相等?D.无法判断
(3)从丙组实验结果分析,HA是?酸(填“强”或“弱”).该混合溶液中离子浓度由大到小的顺序是?.
参考答案:
本题解析:
本题难度:一般
3、选择题 在常温下,下列各组溶液的c(H+)一定等于1×10-7mol/L的是( )
A.pH=2和pH=12的两种溶液以等体积混合
B.0.10mol/L?H2SO4与0.10mol/L?NaOH溶液以等体积混合
C.将pH=5的CH3COOH溶液稀释100倍
D.pH=1的H2SO4与0.05mol/L?的Ba(OH)2溶液以等体积混合
参考答案:D
本题解析:
本题难度:简单
4、填空题 已知水在25℃和95℃时,其电离平衡曲线如图所示:
(1)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为______.
(2)95℃时,若pH=a的某强酸溶液与pH=b的某强碱溶液等体积混合后溶液呈中性,则a与b应满足的关系是______.
(3)曲线B对应温度下,pH=2的某酸HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5.请分析其原因:______.
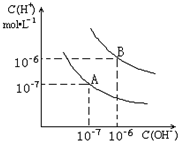
参考答案:(1)中25℃时所得混合溶液的pH=7,溶液呈中性即酸碱恰好中和,即n(OH-)=n(H+),则V(NaOH)?10-5 mol?L-1=V(H2SO4)?10-4 mol?L-1,得V(NaOH):V(H2SO4)=10:1,故答案为:10:1;
(2)要注意的是95°C时,水的离子积为10-12,即酸、碱浓度相等时pH(酸)+pH(碱)=12,即a+b=12,故答案为:a+b=12(或10-a=10b-12);
(3)在曲线B对应温度下,因pH(酸)+pH(碱)=12,可得酸碱两溶液中c(H+)=c(OH-),如是强酸碱,两溶液等体积混合后溶液呈中性;现混合溶液的pH=5,即等体积混合后溶液显酸性,说明H+与OH-完全反应后又有新的H+产生,酸过量,所以酸HA是弱酸,
故答案为:曲线B对应95℃,此时水的离子积为10-12,HA为弱酸,HA中和NaOH后,混合溶液中还剩余较多的HA分子,可继续电离出H+,使溶液pH=5.
本题解析:
本题难度:简单
5、选择题 柠檬是世界上有药用价值的水果之一,对人体十分有益。鲜柠檬维生素含量极为丰富,是美容的天然佳品,能防止和消除皮肤色素沉着,具有美白作用。已知在常温下柠檬水中的c(OH-) =10-11mol/L,则其pH等于
[? ]
A.11
B.7
C.5
D.3
参考答案:D
本题解析:
本题难度:一般