微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 (6分)向100mL水中投入金属钾和金属铝共15g,充分反应后发现有剩余金属1.8g,求反应中共放出氢气多少毫升?(标准状况)
参考答案:8960ml
本题解析:
2K?+ 2H2O = 2KOH + H2↑
2KOH +2Al+ 6H2O = 2K[Al(OH)4] + 3H2↑
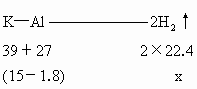
x=8.96 V=8960ml
本题难度:简单
2、选择题 在制作印刷电路板的过程中常利用FeCl3溶液与Cu反应,其反应方程式为:2FeCl3+Cu═2FeCl2+CuCl2.现向FeCl3溶液中加入a?g?Cu粉,完全溶解后,再加入b?g?Fe粉,充分反应后尚有c?g残余固体.若c<a,则下列说法正确的是( )
A.残余固体全部是Cu
B.残余固体可能为Fe和Cu的混合物
C.最后得到的溶液可能含有Fe3+
D.残余固体是Fe,溶液中一定不含Cu2+
参考答案:A
本题解析:
本题难度:一般
3、选择题 某同学对铁的氧化物产生浓厚兴趣,查阅资料后制成以下卡片:
在空气中把铁灼烧至5000C就形成Fe3O4;温度再升高,可形成Fe2O3,在更高的温度下加热Fe2O3(约14000C)时,可失去氧,又得到Fe3O4。即:
|
下列说法正确的是(?)?
A.FeO、Fe2O3、Fe3O4均为黑色固体? B.反应②③均为氧化还原反应
C.热稳定性顺序为:FeO>Fe2O3>Fe3O4
D.四氧化三铁中铁元素的化合价复杂,若写成氧化物的形式,则化学式可写为FeO·Fe2O3;若视四氧化三铁为一种盐,则其化学式可写为Fe2(FeO2) 2
参考答案:B
本题解析:A 错误,Fe2O3是红棕色固体
B 正确,反应②③铁元素都有化合价的变化,所以,都是氧化还原反应。
C 错误,热稳定性顺序为:FeO>Fe3O4>Fe2O3
D 错误,四氧化三铁中铁元素的化合价复杂,若视四氧化三铁为一种盐,则其化学式可写为Fe(FeO2) 2
本题难度:一般
4、填空题 (15分)聚合硫酸铁又称聚铁,化学式为 ,广泛用于污水处理。实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O )过程如下:
,广泛用于污水处理。实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O )过程如下:
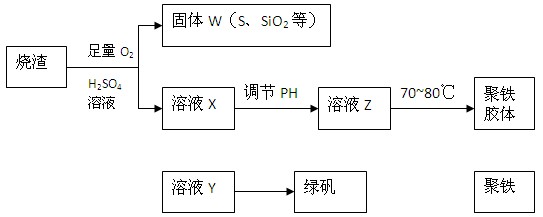
(1)验证固体W焙烧后产生的气体含有SO2的方法是___。
(2)制备绿矾时,向溶液X中加入过量___,充分反应后,经_____操作得到溶液Y,再经浓缩,结晶等步骤得到绿矾。
(3)溶液Z的pH影响聚铁中铁的质量分数,用pH试纸测定溶液pH的操作方法为____。若溶液Z的pH偏小,将导致聚铁中铁的质量分数偏_____。
(4)古代将绿矾煅烧可制绿矾油(也叫镪水,即硫酸)和红色颜料(Fe2O3),请写出有关的化学方程式:
??。
(5)绿矾还可用以下方法生产红色颜料(Fe2O3),其具体操作流程是:将5560kg绿矾(摩尔质量为278 g/mol)溶于水中,加入适量氢氧化钠溶液恰好完全反应,鼓入足量空气搅拌,产生红褐色胶体;再向红褐色胶体中加入16680 kg 绿矾和560 kg铁粉,鼓入足量空气搅拌,反应完成后,有大量Fe2O3附着在胶体粒子上以沉淀形式析出;过滤后,沉淀经高温灼烧得红色颜料。若所得滤液中溶质只有硫酸钠和硫酸铁,则理论上可生产红色颜料____________________kg。
参考答案:(1)将气体通入品红溶液中,如品红褪色,加热后又变红,注明有二氧化硫。
(2)铁粉?过滤
(3)将试纸放到表面皿上,用玻璃棒蘸取溶液,点到试纸的中央,然后根标准比色卡对比?低
(4)2FeSO4·7H2O Fe2O3+SO2↑+SO3↑+14H2O、SO3+H2O=H2SO4
Fe2O3+SO2↑+SO3↑+14H2O、SO3+H2O=H2SO4
(5)4000
本题解析:(1)二氧化硫具有漂泊性可以使品红溶液褪色,但其漂白不是很稳定,加热后又可恢复原来颜色。
(2)溶液X中含有Fe3+,必须除去,但又不能引入新的杂质,可选用铁粉,过量的铁粉通过过滤除去.
(3)检验溶液的pH值是一定不能先润湿pH试纸,也不能插入到溶液中,正确的方法是将试纸放到表面皿上,用玻璃棒蘸取溶液,点到试纸的中央,然后根标准比色卡对比。若溶液Z的pH偏小,说明酸性较强,会是的聚铁中氢氧根偏少,硫酸根偏多,因而铁的质量分数偏低。
(4)依据题意可得该反应属于氧化还原反应,有二氧化硫生成,方程式为
2FeSO4·7H2O Fe2O3+SO2↑+SO3↑+14H2O、SO3+H2O=H2SO4。
Fe2O3+SO2↑+SO3↑+14H2O、SO3+H2O=H2SO4。
(5)根据方程式可计算需要氢氧化钠的物质的量是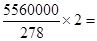 40000mol,由原子守恒知硫酸钠的物质的量是20000mol。所以最终生成的硫酸铁中的SO42-来自最后加入的绿矾,最后加入的绿矾是
40000mol,由原子守恒知硫酸钠的物质的量是20000mol。所以最终生成的硫酸铁中的SO42-来自最后加入的绿矾,最后加入的绿矾是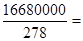 60000mol,生成硫酸铁20000mol。总的铁原子是
60000mol,生成硫酸铁20000mol。总的铁原子是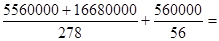 90000mol,由铁原子守恒知Fe2O3的量是
90000mol,由铁原子守恒知Fe2O3的量是
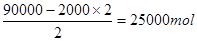 ,质量是4000kg。
,质量是4000kg。
本题难度:简单
5、实验题 (6分)按图中所示装置,用两种不同操作分别进行实验.回答有关问题:
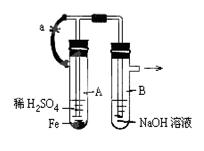
(1)按图示连接好装置,打开止水夹a,在B中可观察到的现象是?,
A中发生反应的化学方程式是?;
(2)反应片刻后,夹紧止水夹a,此时可观察到的现象有:__?__,B中发生反应的离子方程式是:?。
参考答案::(1)有无色气泡产生,Fe+H2SO4= FeSO4+H2↑;
(2)A中的溶液进入B中有白色沉淀产生,Fe2++2OH-= Fe(OH)2↓
本题解析:(1)A中发生反应Fe+H2SO4= FeSO4+H2↑,打开止水夹a,H2进入B中,则B中可看到有无色气泡产生。
(2)夹紧止水夹a后,A中气体压强增大,把FeSO4压至B中与氢氧化钠反应,则可看到B中有白色沉淀产生。离子方程式:Fe2++2OH-= Fe(OH)2。
点评:掌握铁的氢氧化物的制备方法。
本题难度:一般