微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 根据以下叙述制备氯化铜:先将浓盐酸用蒸汽加热至80 ℃左右,慢慢加入含有FeO杂质的CuO粉,充分反应,使其溶解。已知:FeS不溶于水,但溶于酸。
溶液中被沉淀离子
| Fe3+
| Fe2+
| Cu2+
|
完全生成氢氧化物沉淀时,溶液的pH
| ≥3.7
| ≥9.6
| ≥6.4
|
?
在除去溶液中的Fe2+时,可采用的方法是( )
A.可直接加碱,调整溶液的pH≥9.6
B.加入纯铜粉,将Fe2+还原为Fe
C.先将Fe2+氧化成Fe3+,再调整溶液pH至3~4
D.通入H2S使Fe2+直接沉淀
参考答案:C
本题解析:当溶液达到Fe2+沉淀所需pH时,溶液中的Cu2+已经沉淀完全,无法分离;Cu与Fe2+不反应;由已知信息中FeS溶于酸知选项D错;故应先把Fe2+氧化成Fe3+,再调节pH使之沉淀,最后分离即可。
本题难度:一般
2、选择题 下列叙述正确的是
[? ]
A.钠钾合金可用作原子反应堆的导热剂是因为钠、钾金属很活泼
B.做锅热反应实验时,镁条的作用是还原剂
C.铜的氧化物有CuO和Cu2O,其中Cu2O不稳定,在空气中加热易转变为CuO
D.氧化铁或氢氧化铁中的铁元素为+3价,故在氧化还原反应中只作氧化剂
参考答案:C
本题解析:
本题难度:简单
3、填空题 (16分)铁及其化合物在生活、生产中有广泛应用。请回答下列问题:

(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为
3FeS2+8O2 ==6SO2+Fe3O4,氧化产物为?,若有3 mol FeS2参加反应,
==6SO2+Fe3O4,氧化产物为?,若有3 mol FeS2参加反应,
转移?mol电子。
(2)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为?。
(3)与明矾相似,硫酸铁也可用作净水剂,其原理为?(用离子方程表示)?
(4)①钢铁的电化腐蚀简单示意图如右,将该图稍作修改即可成为钢铁电化学防护的简单示意图,请在下图虚线框内作出修改,并用箭头标出电子流动方向。
②写出修改前的钢铁吸氧腐蚀石墨电极的电极反应式?。
(5)铁红是一种红色颜料,其成分是Fe2O.3将一定量的铁红溶于160ml5 mol·L—1盐酸中,在加入一定量铁粉恰好溶解,收集到2.24L(标准状况),经检测,溶夜中无Fe3+,则参加反应的铁粉的质量为?。
参考答案:(1)SO2、Fe3O4? 32?(2)2Fe3++Cu=2Fe2++Cu2+?(3)Fe3++3H2O  Fe(OH)3胶体+3H+
Fe(OH)3胶体+3H+
(4)①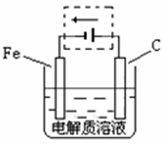 ?②O2+2H2O+4e-=4OH-?(5)11.2g
?②O2+2H2O+4e-=4OH-?(5)11.2g
本题解析:(1)根据方程式可知,FeS2中Fe和S的化合价分别从+2价升高到+8/3价和从-1价升高到+4价,所以FeS2是还原剂,SO2和四氧化三铁都是氧化产物;若有3 mol FeS2参加反应,转移电子的物质的量是(2+6×5)=32mol。
(2)铁离子具有氧化性,能氧化单质铜,方程式2Fe3++Cu=2Fe2++Cu2+。
(3)硫酸铁溶于水电离出的铁离子能水解生成氢氧化铁胶体,胶体具有吸附性,所以可作净水剂,方程式为Fe3++3H2O 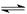 Fe(OH)3胶体+3H+。
Fe(OH)3胶体+3H+。
(4)①该装置是铁的电化学腐蚀,所以要保护铁,则可以通过外接电流的阴极保护法,即铁和电源的负极,作阴极,碳和电源的正极相连,作阳极,如同所示。
②原电池中负极失去电子,正极得到电子,所以正极反应式是O2+2H2O+4e-=4OH-。
(5)盐酸是0.8mol,生成的氢气是0.1mol,所以和氧化铁中氧元素结合的氢原子是0.6mol,因此氧化铁是0.1mol,生成0.2mol氯化铁。0.2mol氯化铁消耗铁是0.1mol,生成氢气消耗铁是0.1mol,所以参加反应的铁是0.2mol,质量是11.2g。
本题难度:一般
4、填空题 A~G各物质间的关系如图,其中B、D为气态单质。
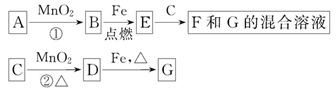
请回答下列问题。
(1)物质C和E的名称分别为_______、_______;
(2)可选用不同的A进行反应①,若能在常温下进行,其化学方程式为_________;若只能在加热情况下进行,则反应物A应为______________;
(3)MnO2在反应①和反应②中的作用分别是_______、_______;
(4)新配制的F溶液应加入_______以防止其转化为G。检验G溶液中阳离子的常用试剂是_______,实验现象为________________________________________。
参考答案:(1)浓盐酸?四氧化三铁
(2)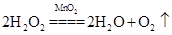 ? KClO3
? KClO3
(3)催化剂?氧化剂?
(4)铁屑? KSCN溶液?溶液呈红色
本题解析:解答本题注意以下两点:
(1)MnO2常用作催化剂和制Cl2的氧化剂。
(2)Fe为变价金属,Fe2+易被氧化。
由转化关系图可推出B、D一个是Cl2,一个是O2,E和C反应生成F和G的混合物,可确定B为O2,D为Cl2,则C为浓盐酸,G为FeCl3,E为Fe3O4,F为FeCl2,根据实验室制O2的反应条件可知,常温下发生①,则A为H2O2,加热条件下发生①,则A为KClO3,为了防止Fe2+被氧化,在其溶液中常加入铁屑,检验Fe3+常用的试剂为KSCN溶液,实验现象为溶液呈红色。
本题难度:一般
5、实验题 (14分)某探究小组的同学设计实验探究铁与水蒸气的反应,并探究反应后生成物的一系列性质。
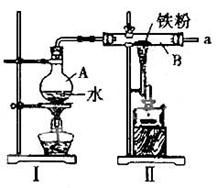
(1)右图为铁与水蒸气反应的实验装置,实验前应先进行的操作是________________
________________?__。
(2)图I为产生水蒸气的装置,图II为铁与水蒸气反应的装置,写出硬质玻璃管B内所发生反应的化学方程式______?________________________________。
(3)为了验证硬质玻璃管B中反应后的气体产物是H2,还需从下图中选择必要的仪器和药品,设计出一套装置,其连接顺序为:a连_______,_______连_______,_______连________。(填下列装置的接口字母)
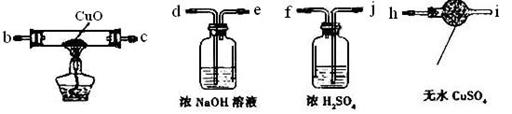
(4)反应后,将图II装置中硬质玻璃管B内的全部固体置于试管中,加入60mL1mol/L的稀盐酸,固体恰好完全溶解,再滴加KSCN溶液,发现溶液不显血红色,写出此过程中所有可能发生反应的离子方程式__________?__、_________________________、________________________。反应前硬质玻璃管B中加入Fe粉的质量为__________g.
参考答案:

本题解析:略
本题难度:一般