微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分,每空2分)
实验室用固体烧碱配制500 mL 0.100 mol/L NaOH溶液。
(1)需用托盘天平称量________g烧碱。
(2)配制过程中需要的仪器为托盘天平、药匙、烧杯、玻璃棒 、 。
(3)下列操作对所配溶液浓度偏高的是 对所配溶液浓度偏低的是 。
①转移溶液时有少量液体溅出 ②溶液未冷却至室温就加水定容
③定容时俯视液面 ④未洗涤烧杯和玻璃棒
参考答案:30.(1)2.0 (2)500 mL容量瓶、 胶头滴管 (3)②③;①④
本题解析:(1)需氢氧化钠的质量为m=0.5L×0.10mol?L-1×40g/mol=2.0g;(2)(1)操作步骤有计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水加入烧杯),并用玻璃棒搅拌,加速溶解.冷却后转移到500mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.所以所需仪器有托盘天平、烧杯、玻璃棒、500mL容量瓶、胶头滴管.根据提供的仪器可知,还需要的仪器有:500ml容量瓶、胶头滴管,答案为:500ml容量瓶、胶头滴管;(3)① 转移溶液时有少量液体溅出,导致溶质减少,所配溶液浓度偏低;②溶液未冷却至室温就加水定容,根据热胀冷缩,会使溶液体积减少,所配溶液浓度偏高;③定容时俯视液面,使溶液的体积偏低,所以溶液浓度偏高;④未洗涤烧杯和玻璃棒,会使溶质减少,所配溶液浓度偏低,所以下列操作对所配溶液浓度偏高的是②③,对所配溶液浓度偏低的是①④。
考点:考查物质的量浓度溶液的配制,误差分析等知识。
本题难度:一般
2、填空题 (1)37Cl—离子结构示意图 ??,质量相等的两种物质SO2和SO3,所含氧原子个数之
为?????;
(2)20.6g NaR 含有Na+0.2mol,则NaR的摩尔质量为?,则含R 8.0g 的NaR的物质的量为?;
(3)在标准状况下,4.8g甲烷(CH4)所占的体积为_________L,它与标准状况下________L硫化氢(H2S)含有相同数目的氢原子;
(4)在100g浓度为18 mol·L-1、密度为ρ(g·cm–3)的浓硫酸中加入一定量的水稀释成9mol·L-1的硫酸,则加入水的体积?100mL(填“>”、“<”、“=”)
参考答案:(1)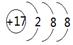 ?5: 6
?5: 6
(2)103 g/mol(单位不写不得分); 0.1 mol
(3)6.72;? 13.44
(4)<
本题解析:(1)Cl?为18电子,第三层电子数为8;质量相等的两种物质SO2和SO3,所含氧原子个数之为m÷64×2:m÷80×3=5:6。
(2)Na+为0.2mol,则NaR为0.2mol,M(NaR)=20.6g÷0.2mol=103g/mol;由NaR的摩尔质量可得M(R)=80g/mol,则n(NaR)=n(R)=8.0g÷80g/mol=0.1mol。
(3)根据气体摩尔体积进行计算,V(CH4)=4.8g÷16g/mol×22.4L/mol=6.72L;4.8g÷16g/mol×4=V(H2S)÷22.4L/mol×2,可得V(H2S)=13.44L。
(4)由18 mol·L-1H2SO4稀释为9mol·L-1,应使溶液体积变为原来的2倍,因为硫酸溶液的密度随着浓度的减小而减小,稀释后的硫酸溶液质量小于原溶液的2倍,所以加入水的体积小于100ml。
本题难度:一般
3、计算题 从100 mL某种待测浓度的Na2CO3溶液中取出50 mL,加入100ml 4mol/L的盐酸溶液,恰好完全反应。
(1)生成标准状况下CO2的体积是多少?? (2)待测Na2CO3溶液的物质的量浓度是多少?
参考答案:(1)4.48L?(2)4mol/L
本题解析:考查根据方程式进行的有关计算。
(1)100ml 4mol/L的盐酸的物质的量是0.1L×4mol/L=0.4mol
Na2CO3+2HCl=2NaCl+CO2↑+H2O
1mol? 2mol? 22.4L
n? 0.4mol? V
所以V=0.4mol×22.4L÷2mol=4.48L
n=1mol×0.4mol÷2mol=0.2mol
(2)碳酸钠溶液的浓度是0.2mol÷0.05L=4mol/L
本题难度:简单
4、填空题 0.2mol NH3 质量为________,在标准状况下的体积为_______,所含氢原子的物质的量为_______,将其溶于水配制成1L溶液,所得溶液中溶质的物质的量浓度为________。
参考答案:3.4g;4.48L;0.6mol;0.2mol/L
本题解析:
本题难度:简单
5、选择题 将10g由Mg、Zn、Fe组成的混合物与40mL稀硫酸恰好完全反应,产生的氢气在标准状况下为5.6L,则三种金属的物质量之和为
A.0.5mol
B.0.25mol
C.0.1mol
D.0.125mol