微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (1)已知短周期元素X的电离能数据如下(kJ·mol-1):
电离能
| I1
| I2
| I3
| I4
|
X
| 577
| 1817
| 2745
| 11578
|
由X的电离能数据判断,X通常显?价。
(2)单质硼有无定形和晶体两种,参考下表数据回答:
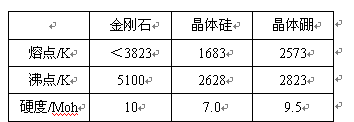
①晶体硼的晶体类型属于__________晶体,理由是_____________________________。

②已知晶体硼的结构单元是由硼原子组成的正二十面体(如下图),其中有20个等边三角形的面和一定数目的顶角,每个顶角各有一个硼原子。通过观察图形及推算,得出此基本结构单元是由__________个硼原子构成的,其中B—B键的键角为____________。
参考答案:(1)+3
(2)①原子?熔点高硬度大,且各项数据介于金刚石与晶体硅之间
②12?60°
本题解析:(1)观察表中数据可知I4的数值与差别很大,故X通常显+3价。
(2)①根据熔沸点和硬度判断。晶体硼的晶体类型属于原子,原因是熔点高硬度大,且各项数据介于金刚石与晶体硅之间。
②B原子个数和B—B键的个数分别为1/5×3×20=12,1/2×3×20=30,夹角是60°。
点评:本题考查的是电离能和晶胞的计算的相关知识,题目难度中,注意基础知识的学习、掌握及应用。
本题难度:一般
2、选择题 下列叙述正确的是
A.分子晶体中只存在分子间作用力,不含有其他化学键
B.在单质的晶体中一定不存在离子键
C.任何晶体中,若含有阳离子也一定含有阴离子
D.金属在常温下都以晶体形式存在
参考答案:B
本题解析:分子晶体中只存在分子间作用力,也含有其他化学键。石墨中存在金属键,在单质的晶体中一定不存在离子键。金属晶体中有阳离子可能没有阴离子。
本题难度:一般
3、填空题 天然气既是重要的能源,也是重要的化工原料,其主要成分是甲烷。
(1)甲烷在一定条件下可生成:
A.碳正离子(CH3-) ? B.碳负离子(CH3-)
C.甲基(—CH3)?D.碳烯(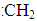 )
)
①四种微粒中,键角为120°的是________。(填序号)
②与碳负离子(CH3-)互为等电子体的一种分子的结构式为_________________________________________________________。
(2)海底富藏大量的可燃冰(甲烷的水合物),关于可燃冰的说法中正确的是________。
A.甲烷分子与水分子均是极性分子
B.可燃冰中甲烷分子与水分子间以氢键相结合
C.可燃冰属于原子晶体
D.甲烷分子与水分子中的σ键均是s—sp3电子云重叠而成的
(3)在高温下,甲烷可还原CuO得到Cu2O。
①Cu+的核外电子排布式为____________。
②Cu2O晶体的晶胞结构如图所示。其中“△”代表的离子符号为________。

(4)一定条件下,甲烷与水蒸气可生成H2和CO。则所生成的气体中σ键总数与π键总数之比为________。
参考答案:(1)①A ② (2)D (3)①[Ar]3d10
(2)D (3)①[Ar]3d10
②O2- (4)2∶1
本题解析:(1)A中碳原子杂化为0+3=3,sp2,平面三角形。B中为1+3=4,sp3杂化,三角锥形。C中为1+3=4,sp3杂化,三角锥形。D中为1+2=3 ,sp2,平面三角形,由于孤电子对斥力大,所以键角小于120°。(2)A项,甲烷分子中正、负电荷中心重合,非极性分子,错误。B项甲烷中C—H无法形成氢键,错误。C项,可燃冰属于分子晶体,错误。(3)中由晶胞可知,黑球为4,白球为1,由于Cu2O,离子个数比为2∶1,可知,中心为氧离子。注意写Cu+,不是铜原子。
本题难度:一般
4、选择题 下列有关金属的说法不正确的是
A.金属的导电性、导热性、延展性都与自由电子有关
B.六方最密和面心立方最密的原子堆积方式空间利用率最高
C.钠晶胞结构如下图,钠晶胞中每个钠原子的配位数为6

D.温度升高,金属的导电性将变小
参考答案:C
本题解析:C项:钠晶胞中每个钠原子的配位数为8,故错。故选C。
点评:体心立方堆积──钾型:这是非密置层的另一种堆积方式,将上层金属填入下层金属原子形成的凹穴中,每层均照此堆积。这种堆积方式形成的每个晶胞含2个原子,配位数为8。钾、钠、铁等金属采用这种堆积方式,简称为钾型。这种堆积方式的空间利用率显然比简单立方堆积的高多了。
本题难度:一般
5、填空题 (14分)由氧化物经氯化作用生成氯化物是工业生产氯化物的常用方法,Cl2、CCl4是常用的氯化剂。如:
Na2O+Cl2=2NaCl+O2
CaO+Cl2=CaCl2+O2
SiO2+2CCl4=SiCl4+2COCl2
Cr2O3+3CCl4=2CrCl3+3COCl2
请回答下列问题:
⑴写出铬的原子结构示意图为?与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有____________(填元素符号),其中一种金属的晶胞结构如图所示,该晶胞中含有金属原子的数目为________。

⑵ CCl4分子中C原子采取?杂化成键。
⑶ COCl2俗称光气,分子中C原子采取sp2杂化成键。光气分子的结构式是?,其中碳氧原子之间共价键是?(填序号)
a.2个σ键?b.2个π键?c.1个σ键、1个π键

⑷ CaO晶胞如右图所示,CaO晶体中Ca2+的配位数为?。CaO晶体和NaCl晶体中离子排列方式相同,其晶格能分别为:CaO-3401kJ?mol-1、NaCl-786kJ?mol-1。导致两者晶格能差异的主要原因是?。
参考答案:(14分)
⑴?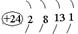 (2分)? K、Cu(各1分,多写此格不给分)? 4(1分)
(2分)? K、Cu(各1分,多写此格不给分)? 4(1分)
⑵ sp3(1分)?⑶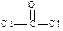 ?(2分)?c(2分)?
?(2分)?c(2分)?
⑷ 6?(2分)? Ca O晶体中离子的电
O晶体中离子的电 荷数大于NaCl (2分)
荷数大于NaCl (2分)
本题解析:略
本题难度:一般