微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 在形形色色的分子世界中,由于分子中的原子的空间关系问题而形成了所谓的“分子的立体结构”;一般来说,所有的双原子分子的空间构型呈________ 形,三原子分子的立体结构有__________ 形和____________ 形两种,大多数的四原子分子采取_________ 形和__________ 形两种立体结构,但也有例外,如白磷(P4)的空间结构与甲烷一样都呈________ 形。
参考答案:直线;V;直线;三角锥;平面三角;正四面体
本题解析:
本题难度:一般
2、填空题 下表为元素周期表的一部分,元素①-⑦是短周期的主族元素,请参照元素①-⑥在表中的位置,回答下列问题:
(1)写出⑥在元素周期表中的位置______.
(2)②的气态氢化物的沸点______⑥的气态氢化物的沸点.(填大于、小于或等于)
(3)④的最高价氧化物与③的最高价氧化物对应的水化物的水溶液反应的离子方程式为
______.
(4)①和⑤形成的化合物是化工行业已合成的一种硬度很大、熔点很高的晶体,若已知在此化合物中各元素均处于其最高或最低价态,据此推断:该化合物的化学式可能是______,与该化合物晶体类型相同的是______(请用相应的编号填写).
(5)由①和③形成的化合物甲和乙,甲受到撞击会分解生成一种固体单质和一种气体单质,此反应中反应物、固体单质和气体单质的物质的量之比是2:2:3;乙中加入过量的盐酸后生成两种盐,在其中一种盐中加入NaOH溶液后加热,能产生使湿润的红色石蕊试纸变蓝的气体.则化合物甲的化学式为______,化合物乙与过量盐酸反应的化学方程式为______.
参考答案:根据元素在周期表中的分布知识,可以推知①是N②是O③是Na④是Al⑤是Si⑥是S⑦是Cl.
(1)S在周期表中的位置是:第3周期 VIA族,故答案为:第3周期VIA族;
(2)分子量越大,氢化物的沸点越高,在水分子间存在氢键,所以沸点高于硫化氢,故答案为:大于;
(3)Al的最高价氧化物Al2O3,是两性氧化物,与Na的最高价氧化物对应的水化物氢氧化钠的水溶液反应的离子方程式为:Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O;
(4)氮化硅Si3N4是一种原子晶体的化合物,硬度很大、熔点很高,具有空间网状结构,与C具有相同的结构,故答案为:Si3N4 ;C;
(5)叠氮化钠甲受到撞击会分解生成金属钠单质和氮气,铵盐中加入NaOH溶液后加热,能产生使湿润的红色石蕊试纸变蓝的气体氨气,所以乙中加入过量的盐酸后生成氯化铵和氯化钠,化合物乙是Na3N,故答案为:NaN3;Na3N+4HCl=3NaCl+NH4Cl.
本题解析:
本题难度:一般
3、选择题 下列判断正确的是
A.酸酐一定是氧化物
B.晶体中一定存在化学键
C.碱性氧化物一定是金属氧化物
D.正四面体分子中键角一定是
参考答案:C
本题解析:略
本题难度:一般
4、填空题 金属晶体是面心立方体,立方体的每个面5个金原子紧密堆砌(如图其余各面省略),金原子半径为d m,求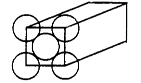
(1)金晶体中最小的一个立方体含有__________个金属原子。
(2) 欲计算一个晶胞的体积,除假定金原子是刚性小球外,还应假定??;
(3)计算一个晶胞的体积是?cm3;
(4)金的密度为_________g?cm-3。
(5)列式计算金原子的空间利用率?
参考答案:(1)4? (2) 立体各面上对角线上的球相切?(3)16 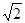 ?d3×106
?d3×106
(4)197/4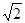 N d3×106?(5)
N d3×106?(5)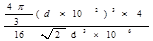
本题解析:(1)根据面心立方体的晶胞结构可知,含有的原子有8×1/8+6×1/2=4。
(2)还应假定立方体各面上对角线上的球是相切的。
(3)设立方体的边长是x。因为面对角线的是4d m,所以边长x=2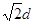 m。因此一个晶胞的体积是x3=16
m。因此一个晶胞的体积是x3=16 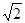 ?d3×106 cm3。
?d3×106 cm3。
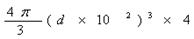 (4)1个晶胞的质量是
(4)1个晶胞的质量是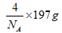 ,所以密度是
,所以密度是 。
。
(5)4个金原子的体积是?,所以金原子的空间利用率为
本题难度:一般
5、计算题 由烷基镁热分解制得镁的氢化物。实验测定,该氢化物中氢的质量分数为7.6%,氢的密度为0.101 g cm?3,镁和氢的核间距为194.8 pm。已知氢原子的共价半径为37pm,Mg2+ 的离子半径为72 pm。
⑴ 写出该氢化物中氢的存在形式,并简述理由。?
⑵ 将上述氢化物与金属镍在一定条件下用球磨机研磨,可制得化学式为Mg2NiH4的化合物。X-射线衍射分析表明,该化合物的立方晶胞的面心和顶点均被镍原子占据,所有镁原子的配位数都相等。推断镁原子在Mg2NiH4晶胞中的位置(写出推理过程)。?
⑶ 实验测定,上述Mg2NiH4晶体的晶胞参数为646.5 pm,计算该晶体中镁和镍的核间距。已知镁和镍的原子半径分别为159.9 pm和124.6 pm。?
⑷ 若以材料中氢的密度与液态氢密度之比定义储氢材料的储氢能力,计算Mg2NiH4的储氢能力(假定氢可全部放出;液氢的密度为0.0708 g·cm-3)。
参考答案:⑴H-
镁-氢间距离为194.8 pm,Mg2+离子半径为72 pm,则氢的半径为194.8 pm-72 pm =123 pm。此值远大于氢原子的共价半径, 这说明H原子以H? 离子的形式存在。
⑵Mg原子与Ni原子数之比为2 : 1,故每个晶胞中含8个镁原子。所有镁原子的配位数相等,它们只能填入由镍原子形成的四面体空隙。
镁原子的位置用下列坐标参数:
1/4, 1/4, 1/4; 1/4, 1/4, 3/4; 3/4, 3/4, 1/4; 3/4, 3/4, 3/4;
1/4, 3/4, 1/4; 1/4, 3/4, 3/4; 3/4, 1/4, 1/4; 3/4, 1/4, 3/4。
⑶镁镍间的距离为
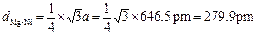 ?
?
不能用原子半径相加计算镁-镍间的距离。
⑷储氢能力=晶体的密度×氢的质量分数÷液氢密度
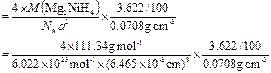 ?
?
= 1.40
=" 1.4"
本题解析:⑴镁-氢间距离为194.8 pm,Mg2+离子半径为72 pm,则氢的半径为194.8 pm-72 pm =123 pm。此值远大于氢原子的共价半径, 这说明H原子以H? 离子的形式存在。
⑵该晶体中,Ni原子按面心立方方式排列,该结构中原子数∶四面体空隙数∶八面体空隙数=1∶2∶1,从Ni和Mg的配位数可知,Mg填入四面体空隙中。
⑶直接利用空间中两点间的距离计算公式,计算(0,0,0)和(1/4,1/4,1/4)两点间的距离。
⑷本题的核心在于检查学生晶体密度的计算公式的掌握及熟练程度,将数据带入公式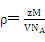 ,求得晶体的密度,乘于氢的质量分数求得储氢密度,最后与液氢的密度相比,求该材料的储氢能力。
,求得晶体的密度,乘于氢的质量分数求得储氢密度,最后与液氢的密度相比,求该材料的储氢能力。
本题难度:一般