微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示,则下列说法正确的是
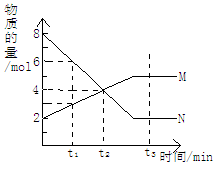
A.反应的化学方程式为:2M N
N
B.t2时,正逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M浓度的2倍
参考答案:D
本题解析:由图可得是N转化为M的反应所以A错误;t2时,M、N物质的量相等,速率不相等,也不平衡,B错误;t3时化学反应平衡,正逆反应速率相等;t1时,N的浓度是M浓度的2倍,D正确。
本题难度:一般
2、选择题 在一个固定体积的密闭容器中加入2mol A,发生可逆反应2A(g)  2B(g)+C(g)。该反应达到平衡的标志是
2B(g)+C(g)。该反应达到平衡的标志是
A.容器内压强是开始时的1.5?
B.容器内A、B、C物质的量浓度之比为2∶2∶1
C.单位时间消耗0.2molA,同时生成0.1molC?
D.容器内各物质的浓度不随时间变化
参考答案:D
本题解析:在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,所以选项D正确。反应是可逆反应,所以2mol的A不可能完全转化为B和C,所以容器内压强一定小于开始时的1.5倍,A不正确;平衡时各种物质的浓度不再发生变化,但各种的浓度之间不一定满足某种关系,B不能说明。C中的反应速率的方向是相同的,则共计反应速率之比是相应的化学计量数之比可知,所以选项C是总是成立的,不正确,因此答案选D。
点评:该题是中等难度的试题,也是高考中的常见题型和考点。试题综合性强,难易适中,侧重对学生能力的培养和解题方法的指导与训练,有助于培养学生的逻辑推理能力和发散思维能力。该题的关键是明确平衡状态的特点,然后结合具体的可逆反应灵活运用即可。
本题难度:一般
3、选择题 在体积不变的密闭容器中,2NO2(g) 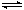 ?N2O4(g) 达到平衡的标志是
?N2O4(g) 达到平衡的标志是
①消耗1 mol NO2的同时消耗1 mol N2O4 ?②容器内NO2 和N2O4的物质的量相等
③混合气体的颜色不再改变?④容器内NO2的物质的量浓度不再变化
A.①②
B.①②③
C.③④
D.①③④
参考答案:C
本题解析:在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,所以选项④正确。颜色的深浅和浓度有关系,混合气体的颜色不再改变,说明NO2的浓度不再发生变化,所以选项③可以说明。①中反应速率的方向相反,但不能满足速率之比是相应的化学计量数之比,不能说明。平衡时各种物质的浓度不再发生变化,但各种的浓度之间不一定满足某种关系,②不能说明,因此答案选C。
点评:该题是中等难度的试题,也是高考中的常见题型和考点。试题基础性强,难易适中,侧重对学生能力的培养和解题方法的指导与训练,有助于培养学生的逻辑推理能力和发散思维能力。该题的关键是明确平衡状态的特点,然后结合具体的可逆反应灵活运用即可。
本题难度:一般
4、实验题 (共12分)在容积固定为2L的密闭容器中,充入0.180 molHI,480℃时反应:
2HI(g) H2(g)+I2(g),体系中n(HI)随时间变化情况如下表:
H2(g)+I2(g),体系中n(HI)随时间变化情况如下表:
t/min
| 0
| 2
| 4
| 6
| 8
| 10
|
n(HI)/mol
| 0.180
| 0.164
| 0.152
| 0.144
| 0.140
| 0.140
|
反应进行至10min后将反应混合物的温度降低,发现气体的颜色变浅。
(1)0~2min内H2的平均反应速度为?。达平衡时,HI的转化率是_________。(2)上述正向反应是:?反应(选填:放热、吸热)。
(3)某温度下上述反应平衡时,恒容、升高温度,原化学平衡向?反应方向移动(填“正”或“逆”),正反应速率?(填“增大”、“减小”或“不变”),容器内混合气体的压强?(填“增大”、“减小”或“不变”)。
(4)480℃时,反应H2(g)+I2(g) 2HI(g)的平衡常数K的值为?。
2HI(g)的平衡常数K的值为?。
(5)要增大反应2HI(g) H2(g)+I2(g)的平衡常数,可采取的措施是?(选填字母)。
H2(g)+I2(g)的平衡常数,可采取的措施是?(选填字母)。
A.增大HI起始浓度
B.向混合气体中通入I2
C.使用高效催化剂?
D.升高温度
参考答案:(1)0.002mol/(L·min),22.2%?(2)吸热
(3)正,增大,增大。?(4)1/49? 5)D
本题解析:(1)0~2min内HI的速率为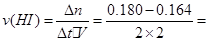 0.004mol/(L·min),由各物质的系数比可推出,
0.004mol/(L·min),由各物质的系数比可推出,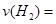 0.002mol/(L·min);
0.002mol/(L·min);
由表格中数据可知,反应到8分钟时,HI的浓度不再改变,即反应已经达到平衡,此时HI的转化率为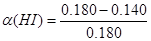 =22.2%
=22.2%
(2)由题意知,可逆反应2HI(g) H2(g)+I2(g)降温时碘蒸气浓度减小,平衡左移,正反应为吸热反应
H2(g)+I2(g)降温时碘蒸气浓度减小,平衡左移,正反应为吸热反应
(3)升温时,平衡向吸热反应方向移动,即正向移动;正逆反应速率均增大;由于两边气体系数相等,混合气体的总物质的量并不改变,但温度升高,由PV=nRT可知,压强增大
(4)由平衡常数的定义可知,在480℃时,K= 1/49
1/49
(5)K只与温度有关,升温平衡右移,K增大,故答案为D
本题难度:一般
5、填空题 可逆反应:aA(g) + bB(g)  cC(g) + dD(g) ΔH=Q;根据图回答:
cC(g) + dD(g) ΔH=Q;根据图回答:
①压强 P1比P2???填(大或小)?
② (a +b)比(c +d) ??填(大或小)
③温度t1℃比t2℃?(高或低)
④ Q值为??填(正或负)(正值表示正反应吸热,负值表示正反应放热)
参考答案:①小(1分)?②小(1分)?③高(1分)?④正(1分)
本题解析:①压强大反应速率就快,到达平衡的时间就少,所以压强 P1比P2小。
②压强大,A的转化率低,说明增大压强平衡向逆反应方向移动,即正反应是体积增大的。
②温度越高反应速率就快,到达平衡的时间就少,所以温度t1℃比t2℃高。
④温度高,A的含量低,说明升高温度平衡向正反应方向移动,即正反应是吸热反应。
本题难度:一般