微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 实验室需配制一种仅含四种离子(不包括水电离出的离子)的无色混合溶液,且在混合溶液中四种离子的物质的量浓度均为1 mol/L。下面四个选项中能达到此目的的是(?)
A.Na+、K+、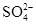 、Cl-
、Cl-
B.Cu2+、K+、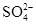 、
、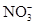
C.H+、K+、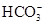 、Cl-
、Cl-
D.Mg2+、Na+、Cl-、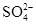
参考答案:D
本题解析:A项,若四种离子的浓度均为1 mol/L,溶液中正、负电荷的总数不相等;B项,含有Cu2+,溶液为蓝色;C项,H+和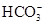 不能大量共存。
不能大量共存。
解答该题易出现的错误是容易忽视题中的部分信息,判断错误。如忽视“混合溶液中四种离子的物质的量浓度均为1 mol/L”,仅考虑离子之间相互不发生反应而错选A项,或忽视“无色溶液”的信息而错选B项。
本题难度:一般
2、选择题 常温下,下列溶液中有关物质的量浓度关系和计算不正确的是
A.c(NH4+)相等的(NH4)2SO4、(NH4)2Fe(SO4)2和NH4Cl溶液中,溶质浓度大小关系是:c(NH4Cl)<c[(NH4)2SO4]<c[(NH4)2Fe(SO4)2]
B.已知25℃时Ksp(AgCl)=1.8×10-10,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到6.0×10-10mol·L-1
C.0.2mol·L-1 HCl溶液与等体积0.05 mol·L-1 Ba(OH)2溶液混合后,溶液的pH="1"
D.室温下,0.1mol?L-1NaHA溶液的pH=4,则有c(HA-)>c(H+)>c(A2-)>c(H2A)
参考答案:C
本题解析:解:(NH4)2SO4溶液中硫酸根离子对铵根离子水解无影响,(NH4)2Fe(SO4)2和溶液中亚铁离子水解显酸性抑制铵根离子的水解,NH4Cl溶液中氯离子对铵根离子无影响,当铵根离子浓度相同时溶质浓度应为,c(NH4Cl)>c[(NH4)2SO4]>c[(NH4)2Fe(SO4)2],故A错误;依据一定温度下沉淀溶解平衡中存在溶度积常数,依据溶度积和沉淀溶解平衡,计算银离子最大浓度;Ksp(AgCl)=1.8×10-10,0.1mol·L-1AlCl3溶液中c(Cl-)为0.3mol·L-1,Ksp(AgCl)=c(Ag+)×c(Cl-)=c(Ag+)×0.3mol·L-1=1.8×10-10;c(Ag+)=6×10-10mol·L-1;故B正确;0.2mol·L-1 HCl溶液与等体积0.05mol·L-1 Ba(OH)2溶液混合后,依据溶液中溶质物质的量分析判断,酸过量,设酸碱溶液体积为1L,盐酸溶液中氢离子物质的量为0.2mol,氢氧化钡溶液中氢氧根离子物质的量为0.1mol,所以混合溶液中c(H+)= 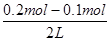 =0.05mol·L-1,溶液的pH=-lg0.05=2-lg5,故C错误;0.1mol·L-1 NaHA溶液的pH=4,溶液呈酸性,说明酸式酸根离子的电离程度大于水解程度,溶液中的离子浓度大小顺序为c(Na+)>c(HA-)>c(H+)>c(A2-)>c(H2A);故D正确;故选C。
=0.05mol·L-1,溶液的pH=-lg0.05=2-lg5,故C错误;0.1mol·L-1 NaHA溶液的pH=4,溶液呈酸性,说明酸式酸根离子的电离程度大于水解程度,溶液中的离子浓度大小顺序为c(Na+)>c(HA-)>c(H+)>c(A2-)>c(H2A);故D正确;故选C。
本题难度:一般
3、选择题 下列各组离子在相应的条件下可以大量共存的是( )
A.在碱性溶液中:CO32-、K+、Cl-、Na+
B.与铝粉反应放出氢气的无色溶液中:NO3-、Mg2+、Na+、SO42-
C.在
═1×1012的溶液中:NH4+、Ca2+、Cl-、K+
D.在中性溶液中:Fe3+、S2-、NO3-、Al3+
参考答案:A.在碱性溶液中,该组离子之间不反应,则能够共存,故A正确;
B.能与金属铝反应放出氢气的溶液,可能为酸或碱溶液,碱溶液与Mg2+结合生成沉淀,不能共存,而酸溶液中有NO3-不能生成氢气,故B错误;
C.在c(H+)c(OH-)═1×1012的溶液中,c(H+)=0.1mol/L,酸溶液中该组离子之间不反应,能共存,故C正确;
D.Fe3+、S2-之间能发生氧化还原反应,则不能共存,故D错误;
故选AC.
本题解析:
本题难度:简单
4、选择题 无色透明的酸性溶液中,能大量共存的是
A.Na+、K+、CO32-、NO3-
B.K+、Fe2+、NH4+、NO3-
C.NH4+、Al3+、SO42-、NO3-
D.K+、Na+、NO3-、OH-