微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (8分)下图表示的是向Na2CO3溶液中滴入稀盐酸(单位为ml)时产生CO2的过程。
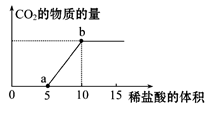
(1)写出a点以前发生反应的离子方程式:
(2)写出a到b点发生反应的离子方程式:
(3)若某Na2CO3溶液中含84.8g Na2CO3,向其中滴入一定量的稀盐酸,恰好使溶液中Cl-和HCO3-的物质的量之比为2∶1,则滴入的稀盐酸中的HCl的物质的量为 mol(保留小数点后两位数字)。
(4)已知HCO3-+OH-=== CO32-+H2O ,若某溶液中含1 mol NaHCO3,滴入一定量的稀NaOH,恰好使溶液中Na+ 和HCO3-的物质的量之比为2:1,则滴入的NaOH的物质的量为 mol。
参考答案:(1)CO32-+H+=== HCO3-(2)HCO3-+H+===CO2↑+H2O (3)1.07 (4)1/3
本题解析:向碳酸钠溶液中滴入稀盐酸,先反应生成碳酸氢钠和氯化钠,再反应生成氯化钠、二氧化碳和水,(1)a点以前发生反应的离子方程式为CO32-+H+===" H" CO3-;(2)a到b点发生反应的离子方程式为HCO3-+H+===CO2↑+H2O;
(3)根据反应Na2CO3+HCl = NaCl+NaHCO3 NaHCO3+HCl=NaCl+CO2↑+H2O
0.8 0.8 0.8 0.8 x x x
列方程(0.8+x):(0.8-x)= 2:1 解得x=0.8/3 则HCl的物质的量为0.8+0.8/3=1.07;
(4)根据HCO3-+OH-=== CO32-+H2O
X X
列方程(X+1)/(1-X)=2:1 解得 X=1/3,则滴入的NaOH的物质的量为1/3mol。
考点:考查碳酸钠的化学性质。
本题难度:一般
2、选择题 对摩尔的叙述正确的是( )
A.摩尔是表示物质微粒数的单位
B.摩尔是表示物质质量的单位
C.摩尔是表示物质数量的单位
D.摩尔是表示物质的量的单位
参考答案:D
本题解析:
本题难度:一般
3、选择题 阿伏加德罗常数约为6.02×1023mol-1,下列说法中正确的是
A.用石墨电极电解Ca(NO3)2溶液,当转移电子数为0.2NA时,阴极析出4g金属
B.l mol C22H46中含有的C—C键个数约为21×6.02×1023
C.0.1mol 24Mg32S晶体中所含中子总数为28×6.02×1023
D.1 mol Na2O2中所含的阴离子数约为2×6.02×1023
参考答案:B
本题解析:A错,阴极电极反应式为:2H++2e—=H2;无金属析出;B正确;C错,0.1mol 24Mg32S晶体中所含中子总数为2.8×6.02×1023;D错,Na2O2中阳离子与阴离子个数比为2:1,1 mol Na2O2中所含的阴离子数约为6.02×1023
本题难度:一般
4、简答题 取10g?NaOH固体,配成500mL溶液,所得溶液c(NaOH)═______mol?L-1;取该溶液50mL,向其中加入1.07g?NH4Cl固体,充分反应后,加热溶液,最多可得到标准状况下氨气的体积为______L.
参考答案:NaOH的物质的量为10g40g/mol=0.25mol,
NaOH溶液的物质的量浓度为0.25mol0.5L=0.5mol/L;
该溶液50mL,NaOH的物质的量为0.05L×0.5mol/L=0.025mol,
1.07g?NH4Cl固体的物质的量为1.07g53.5g/mol=0.02mol,
NH4Cl完全反应,
则NaOH+NH4Cl?△?.?NaCl+NH3↑+H2O,
? 0.02mol? 0.02mol
即生成氨气的物质的量为0.02mol,
则标准状况下氨气的体积为0.02mol×22.4mol/L=0.448L,
故答案为:0.5;0.448.
本题解析:
本题难度:一般
5、选择题 若NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.1mol Cl2作为氧化剂得到的电子数为NA
B.在0℃ 101kPa时,22.4L氢气中含有NA个氢原子
C.NA个一氧化碳分子和0.5mol甲烷的质量比为7:4
D.14g 氮气中含有7NA个电子