微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、推断题 下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出),大部分反应在工业生产中得到实际应用。已知Ⅰ、G是单质,且Ⅰ是一种既能与酸反应又能与碱反应生成氢气的金属,L是一种无色气体,K是一种红棕色气体,E是一种红褐色沉淀。
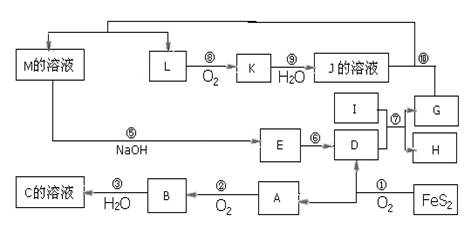
请填写下列空白:
(1)写出下列物质的化学式:C:?;J:?。
(2)写出下列反应的化学反应方程式:
反应⑦:?。
反应⑩:?。
(3)写工业上NH3与O2在一定条件下制取L的化学方程式:?。
参考答案:(每空2分,共10分,条件未写扣一分)
(1)C:H2SO4?J: HNO3?
(2)反应⑦ :? Fe2O3 ?+ 2Al  ?Al2O3 + 2Fe
?Al2O3 + 2Fe
反应⑩:Fe + 4HNO3 = Fe(NO3)3 +NO↑ +2 H2O
(3)4NH3 + 5O2 4NO + 6H2O
4NO + 6H2O
本题解析:I是既能与强酸反应生成氢气又能与强碱反应生成氢气的金属,判断为Al,K是一种红棕色气体,判断为NO2;D的俗名叫铁红为Fe2O3;,A是形成酸雨的主要气体为SO2,由反应4FeS2+11O2  2Fe2O3+8SO2知A、D为Fe2O3、A为SO2,结合A+O2 →B知,A为SO2,D为Fe2O3,B为SO3,C为H2SO4;I是既能与强酸反应生成氢气又能与强碱反应生成氢气的金属为Al;G、H为Al2O3和Fe中的一种;由K是一种红棕色气体,K为NO2,J为HNO3,L为NO;又由G+HNO3 →M+NO↑分析知G为Fe,H为Al2O3;M应为Fe(NO3)3或Fe(NO3)2;联系反应④:M+H2SO4 →F+NO↑知,M为Fe(NO3)2;F为Fe(NO3)3或Fe2(SO4)3;E应为Fe(OH)3,至此全部物质已确定,分别为:A、SO2;B、SO3;C、H2SO4;D、Fe2O3;E、Fe(OH)3;F、Fe(NO3)3或Fe2(SO4)3;G、Fe;H、Al2O3;I、Al;J、HNO3;K、NO2;L、NO;M、Fe(NO3)2;题目所涉及的问题可顺利解决。
2Fe2O3+8SO2知A、D为Fe2O3、A为SO2,结合A+O2 →B知,A为SO2,D为Fe2O3,B为SO3,C为H2SO4;I是既能与强酸反应生成氢气又能与强碱反应生成氢气的金属为Al;G、H为Al2O3和Fe中的一种;由K是一种红棕色气体,K为NO2,J为HNO3,L为NO;又由G+HNO3 →M+NO↑分析知G为Fe,H为Al2O3;M应为Fe(NO3)3或Fe(NO3)2;联系反应④:M+H2SO4 →F+NO↑知,M为Fe(NO3)2;F为Fe(NO3)3或Fe2(SO4)3;E应为Fe(OH)3,至此全部物质已确定,分别为:A、SO2;B、SO3;C、H2SO4;D、Fe2O3;E、Fe(OH)3;F、Fe(NO3)3或Fe2(SO4)3;G、Fe;H、Al2O3;I、Al;J、HNO3;K、NO2;L、NO;M、Fe(NO3)2;题目所涉及的问题可顺利解决。
(1)依据题干条件和推断,A是酸雨主要成分为:SO2,A+O2→B,B+H2O→C,推知C为H2SO4;D为铁红Fe2O3,E为Fe(OH)3,J为HNO3。
(2)反应⑦的化学方程式为铝热反应,化学方程式为:Fe2O3+2Al Al2O3+2Fe。
Al2O3+2Fe。
反应⑩的方程式为:Fe + 4HNO3 = Fe(NO3)3 +NO↑ +2 H2O。
(3)根据教材知识书写其方程式为4NH3 + 5O2 4NO + 6H2O。
4NO + 6H2O。
点评:本题考查了无机化合物的性质转化关系和性质应用,主要利用特征现象进行分析推断各物质,抓住题眼①和题干信息,结合反应和转化关系判断出各物质是解题关键。
本题难度:一般
2、推断题 A、B、C、D、E、F、H、I、J有如图所示的转化关系。图中所有物质均由短周期元素组成,且每个小三角形内的三种物质均至少含有第三周期中的一种相同元素。其他信息见下表
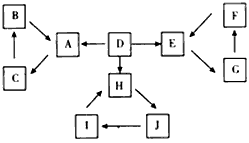

(1)写出F的化学式:________,H的电子式:________。
(2)常温下测得一定浓度的C溶液的pH=10,用离子方程式表示其原因:___________________
(3)写出向C溶液中通入过量CO2的离子方程式:________________。
(4)电解饱和J溶液产物之一为Y2,将一定量的Y2通入一定浓度的氢氧化钾溶液中,两者恰好完全反应时(已知反应过程放热),生成物中有三种含Y元素的离子,其中两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。写出该氢氧化钾溶液中通入Y2的化学方程式:________________。

参考答案:(1)H2SiO3;
(2)AlO2-+2H2O Al(OH)3+OH-
Al(OH)3+OH-
(3)AlO2-+CO2+2H2O==Al(OH)3↓+HCO3-
(4)5Cl2+10KOH=7KCl+2KClO+KClO2+5H2O
本题解析:
本题难度:一般
3、填空题 A. A、B、C、D、E、F为原子序数依次增大的短周期主族元素。 A、F原子的最外层电子数均等于其周期序数,F原子的电子层数是A的3倍;B原子核外电子分处3个不同能级,且每个能级上排布的电子数相同;A与C形成的最简单分子为三角锥形;D原子p轨道上成对电子数等于未成对电子数;E原子核外每个原子轨道上的电子都已成对,E电负性小于F。
⑴写出B的基态原子的核外电子排布式?。
⑵A、C形成的最简单分子极易溶于水,其主要原因是?;与该最简单分子互为等电子体的阳离子为?。
⑶比较E、F的第一电离能:E?F(选填“>”或“<”)。
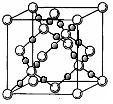
⑷BD2在高温高压下所形成的晶胞如右图所示。该晶体的类型属于?(选填“分子”、“原子”、“离子”或“金属”)晶体,该晶体中B原子的杂化形式为?。
⑸光谱证实单质F与强碱性溶液反应有[F(OH)4]—生成,则[F(OH)4]—中存在?。
a.共价键? b.非极性键? c.配位键? d.σ键? e.π键
B.某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进行研究。
⑴提出假设?①该反应的气体产物是CO2。
②该反应的气体产物是CO。
③该反应的气体产物是?。
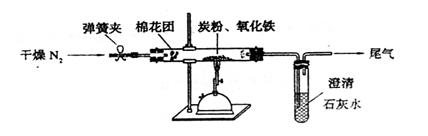
⑵设计方案?如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比。
⑶查阅资料
氮气不与碳、氧化铁发生反应。实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气。
请写出该反应的离子方程式:?。
⑷实验步骤
①按上图连接装置,并检查装置的气密性,称取3.20g氧化铁、2.00g碳粉混合均匀,放入48.48g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水(足量)变浑浊;
④待反应结束,再缓缓通入一段时间的氮气。冷却至室温,称得硬质玻璃管和固体总质量为52.24g;
⑤过滤出石灰水中的沉淀,洗涤、烘干后称得质量为2.00g。
步骤②、④中都分别通入N2,其作用分别为?。
⑸数据处理
试根据实验数据分析,写出该实验中氧化铁与碳发生反应的化学方程式:
?。
⑹实验优化?学习小组有同学认为应对实验装置进一步完善。
①甲同学认为:应将澄清石灰水换成Ba(OH)2溶液,其理由是?。
②从环境保护的角度,请你再提出一个优化方案:?。
参考答案:A.⑴1s22s22p2?⑵NH3与H2O间能形成氢键? H3O+?⑶>?⑷原子? sp3?⑸acd
(第⑷小题每空1分,其余每空2分,共12分)
B.⑴CO2、CO的混合物?⑶NH4++NO2—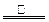 N2↑+2H2O
N2↑+2H2O
⑷步骤②中是为了排尽空气;步骤④是为了赶出所有的CO2,确保完全吸收
⑸2C+Fe2O3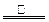 2Fe+CO↑+CO2↑
2Fe+CO↑+CO2↑
⑹①Ba(OH)2溶解度大,浓度大,使CO2被吸收的更完全;M (BaCO3)>M(CaCO3),称量时相对误差小。
②在尾气出口处加一点燃的酒精灯或增加一尾气处理装置
(每空2分,共12分)
本题解析:略
本题难度:一般
4、选择题 已知A、B为单质,C为化合物。能实现上述转化关系的是
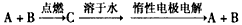
①若C溶于水后得到强碱溶液,则A可能是Na
②若C溶液遇Na2CO3,放出CO2气体,则A可能是H2
③若C溶液中滴加KSCN溶液显红色,则B可能为Fe
④若C溶液中滴加NaOH溶液有蓝色沉淀生成,则B可能为Cu
A.①②
B.②④
C.①③
D.③④
参考答案:B
本题解析:
本题难度:一般
5、推断题 A~J是中学化学中常见的几种物质,它们之间的转化关系如图所示。已知常温下A为固 体单质,B为淡黄色粉末,C、F、I为气态单质,E在常温下为液体,且E可由C、F合成,J可用作杀菌消毒剂。
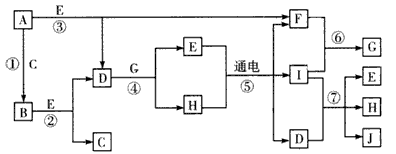
回答下列问题:
(1)B中的化学键有___(填“离子键”、“极性键”或“非极性键”),E的电子式为____。
(2)写出反应⑦的离子方程式:________。
(3)向AICl3溶液中加入少量固体B,写出反应的化学方程式:____。
(4)以Pt为电极电解滴加有少量酚酞的H饱和溶液,则在___(填“阴”或“阳”)极附近溶液由无色变为红色,其原 因是____。
参考答案:(1)离子键、非极性键; 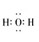
(2)Cl2+2OH-==Cl-+ClO-+H2O
(3)4AlCl3+6Na2O2+6H2O==4Al(OH)3↓+12NaCl+3O2↑
(4)阴 ;在阴极由于H+得到电子产生H2,破坏了水的电离平衡,促进水继续电离,导致溶液中
c(OH-)>c(H+),溶液呈碱性,所以阴极附近溶液变为红色
本题解析:
本题难度:一般