微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列化学式能真实表示物质分子组成的是?
①NaOH?②SiO2 ?③SO3?④He?⑤P? ⑥Na2O2
A.②③⑤
B.③⑤
C.③④
D.③④⑤
参考答案:C
本题解析:在离子晶体和原子晶体中不存在分子,所以其化学式不能代表物质的分子组成。只有在分子晶体中才存在分子,其化学式代表物质的分子组成。因为磷有多种同素异形体,所以⑤也不能代表物质的分子组成。答案是C。
本题难度:简单
2、选择题 下列各组中每种物质都既有离子键又有共价键的一组是:
A.NaOH? H2SO4? (NH4)2SO4
B.MgO? Na2SO4? HNO3
C.Na2O2? KOH? Na3PO4
D.HCl? Al2O3? MgCl2
参考答案:C
本题解析:考查化学键的判断。A中H2SO4只有共价键。B中MgO只有离子键,HNO3只有共价键。D中HCl只有共价键,Al2O3、MgCl2只有离子键。所以答案是C。
本题难度:一般
3、选择题 下列分子中所有原子都满足最外层8电子结构的是
A.CH3Br
B.SF6
C.CCl4
D.BF3
参考答案:C
本题解析:只要含有氢原子,其最外层就不可能满足8电子结构。B中硫原子已经达到12个电子。D中B原子是6个电子的,只有选项C正确。即如果该元素的化合价的绝对值和最外层电子数之和满足8,那么该原子的最外层就满足8电子结构。答案是C。
本题难度:简单
4、选择题 下列分子或离子的空间构型为平面三角形的是
A.SiH4
B.H3O+
C.SO32-
D.NO3-
参考答案:D
本题解析:试题分析:立体构型为平面三角形的分子应含有3个δ键,且没有孤对电子,中心原子为sp2杂化,据此将进行解答。A、Si原子形成4个δ键,根据价层电子对互斥理论可知孤对电子数=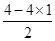 =0,所以为sp3杂化,立体构型为正四面体,因此A不选;B、O原子形成3个δ键,孤对电子数=
=0,所以为sp3杂化,立体构型为正四面体,因此A不选;B、O原子形成3个δ键,孤对电子数=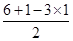 =1,所以为sp3杂化,立体构型为三角锥型,故B不选;C、S原子形成3个δ键,孤对电子数=
=1,所以为sp3杂化,立体构型为三角锥型,故B不选;C、S原子形成3个δ键,孤对电子数=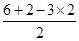 =1,所以为sp3杂化,立体构型为三角锥型,故C不选;D、N原子形成3个δ键,孤对电子数=
=1,所以为sp3杂化,立体构型为三角锥型,故C不选;D、N原子形成3个δ键,孤对电子数=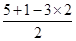 =0,所以中心原子为sp2杂化,立体构型为平面三角形,故D正确,答案选D。
=0,所以中心原子为sp2杂化,立体构型为平面三角形,故D正确,答案选D。
考点:考查分子空间构型的判断
本题难度:困难
5、选择题 下列叙述不正确的是
A.金属与非金属化合时,都能形成离子键
B.阴、阳离子通过静电引力所形成的化学键叫离子键
C.离子化合物也可能完全由非金属元素组成的
D.共价化合物中一定不含有离子键
参考答案:A
本题解析:试题分析:A、Al和Cl结合生成的是共价键,故错。故选A。
考点:化学键
点评:本题考查的是化学键的相关知识,题目难度不大,熟悉化学键的原理是解题的关键。
本题难度:一般