微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列属于天然高分子化合物的是
A.乙醇
B.聚乙烯
C.葡萄糖
D.蛋白质
参考答案:D
本题解析:
本题难度:一般
2、选择题 某工厂用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路.课外活动小组为确认生产后的废液的组成,进行如下实验:(1)取20mL废液加入足量的AgNO3溶液,生成沉淀?17.22g.(2)另取20mL废液放入铜片充分反应,铜片质量减少了0.32g.下列关于原废液组成的判断错误的是
A.一定含有Fe2+、Fe3+、Cu2+、Cl-
B.c(Fe2+):c(Fe3+)=5:2
C.c(Fe2+):c(Cu2+)=2:1
D.c(Cl-)=6.0?mol?L-1,c(Fe2+)=1.5mol?L-1
参考答案:B
本题解析:分析:废液加入足量的AgNO3溶液,生成沉淀17.22g,沉淀为AgCl,根据n= 计算AgCl的物质的量,根据氯元素守恒计算溶液中n(Clˉ),再根据c=
计算AgCl的物质的量,根据氯元素守恒计算溶液中n(Clˉ),再根据c= 计算原废液中c(Clˉ);
计算原废液中c(Clˉ);
废液放入铜片充分反应,铜片质量减少了0.32g,说明溶液中含有Fe3+,根据铜片减少的质量结合方程式计算溶液中Fe3+的物质的量,进而计算原废液中c(Fe?3+);
由方程式2FeCl3+Cu═2FeCl2+CuCl2可知,原废液中c(Fe2+)=2c(Cu2+),根据电荷守恒,原废液中3c(Fe?3+)+2c(Fe2+)+2c(Cu2+)=c(Clˉ),据此计算原废液中c(Fe2+)、c(Cu2+).
解答:A、废液放入铜片充分反应,铜片质量减少了0.3g,说明溶液中含有Fe3+,结合反应2FeCl3+Cu═2FeCl2+CuCl2可知,原废液一定含有Fe2+、Fe3+、Cu2+、Clˉ,故A正确;
B、废液加入足量的AgNO3溶液,生成沉淀?17.22g,沉淀为AgCl,故n(AgCl)= =0.12mol,原废液中c(Clˉ)=
=0.12mol,原废液中c(Clˉ)=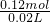 =6mol/L,
=6mol/L,
废液放入铜片充分反应,铜片质量减少了0.32g,物质的量为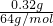 =0.005mol,令20mL废液中Fe3+为nmol,则:
=0.005mol,令20mL废液中Fe3+为nmol,则:
2FeCl3+Cu═2FeCl2+CuCl2
2? 1
nmol?0.005mol
故n=0.010mol,所以原废液中c(Fe?3+)= =0.5mol/L,
=0.5mol/L,
由方程式2FeCl3+Cu═2FeCl2+CuCl2可知,原废液中c(Fe2+)=2c(Cu2+),根据电荷守恒,原废液中3c(Fe?3+)+2c(Fe2+)+2c(Cu2+)=c(Clˉ),原废液中c(Clˉ)=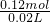 =6mol/L,故3×0.5+2c(Fe2+)+c(Fe2+)=6,解得c(Fe2+)=1.5mol/L,故原废液中c(Fe2+):c(Fe?3+)=1.5mol/L:0.5mol/L=3:1,故B错误;
=6mol/L,故3×0.5+2c(Fe2+)+c(Fe2+)=6,解得c(Fe2+)=1.5mol/L,故原废液中c(Fe2+):c(Fe?3+)=1.5mol/L:0.5mol/L=3:1,故B错误;
C、由方程式2FeCl3+Cu═2FeCl2+CuCl2可知,原废液中c(Fe2+)=2c(Cu2+),故C正确;
D、由B中分析可知,c(Clˉ)=6mol/L,c(Fe2+)=1.5mol/L,故D正确;
故选B.
点评:本题考查根据方程式的计算、混合溶液的有关计算等,难度中等,注意电荷守恒的运用.
本题难度:简单
3、选择题 由Na、Na2O、Na2O2组成的固体混合物,其中各组分的物质的量之和为0.1 mol,将其溶于水,所得溶液恰好能被150 mL浓度为1 mol/L的HCl溶液中和,下列相关描述说法不正确的是
A.中和生成的NaCl为0.15 mol
B.0.1 mol固体混合物与水反应生成H2和O2的体积比可能是1∶1
C.Na、Na2O、Na2O2物质的量之比可能是2∶1∶1
D.Na、Na2O、Na2O2物质的量之比可能是5∶3∶2
参考答案:B
本题解析:
本题难度:简单
4、选择题 在石灰窑中烧制生石灰,1mo1 CuCO3完全分解所需要的能量,可燃烧0.453mo1碳来提供.设空气中O2体积分数为0.21,N2为0.79,则石灰窑产生的气体中CO2的体积分数可能是
A.0.50
B.0.46
C.0.49
D.0.52
参考答案:B
本题解析:分析:由碳燃烧C+O2 CO2可知,0.453mol碳完全燃烧消耗O20.453mol、生成CO20.453mol;由CaCO3分解CaCO3
CO2可知,0.453mol碳完全燃烧消耗O20.453mol、生成CO20.453mol;由CaCO3分解CaCO3 CaO+CO2 ↑可知,1molCaCO3完全分解生成CO21mol,故反应产生的CO2总量为:1.453mol,消耗0.453molO2含有的N2为0.453mol×
CaO+CO2 ↑可知,1molCaCO3完全分解生成CO21mol,故反应产生的CO2总量为:1.453mol,消耗0.453molO2含有的N2为0.453mol× =1.70mol,据此计算判断.注意若碳不完全燃烧则二氧化碳体积分数变小.
=1.70mol,据此计算判断.注意若碳不完全燃烧则二氧化碳体积分数变小.
解答:由碳燃烧C+O2 CO2可知,0.453mol碳完全燃烧消耗O20.453mol、生成CO20.453mol;
CO2可知,0.453mol碳完全燃烧消耗O20.453mol、生成CO20.453mol;
由CaCO3分解CaCO3 CaO+CO2 ↑可知,1molCaCO3完全分解生成CO21mol,
CaO+CO2 ↑可知,1molCaCO3完全分解生成CO21mol,
故反应产生的CO2总量为:0.453mol+1mol=1.453mol,消耗0.453molO2含有的N2为0.453mol× =1.70mol,
=1.70mol,
气体中CO2的体积分数为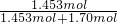 =0.46,这是最大值,如部分生成CO,则二氧化碳体积分数变小.
=0.46,这是最大值,如部分生成CO,则二氧化碳体积分数变小.
故选:B.
点评:本题主要考查混合物反应的计算,难度较大,是对学生运用所学化学知识综合分析和解决实际问题的能力考查,增加了学生分析问题的思维跨度,强调了学生整合知识的能力.
本题难度:一般
5、选择题 将5.1 g镁铝合金投入500 mL 2.0 mol·L-1的盐酸中,金属完全溶解,再加入4.0 mol·L-1的NaOH溶液,若要生成的沉淀最多,则应加入NaOH溶液的体积是 ( )
A.200 mL
B.250 mL
C.425 mL
D.560 mL
参考答案:B
本题解析:试题分析:若要生成的沉淀最多,则恰好反应生成氢氧化镁和氢氧化铝时沉淀最多。此时溶液中的溶质就只有氯化钠,则根据原子守恒可知,氯化钠的物质的量是0.5L×2.0mol/L=1.0mol,所以氢氧化钠的物质的量也是1.0mol,则氢氧化钠溶液的体积是1.0mol÷4.0mol/L=0.25L=250ml,答案选B、
考点:考查镁铝合金与酸碱反应的有关计算
点评:该题是高考中的常见题型,属于中等难度试题的考查。试题综合性强,在注重对学生基础知识巩固和训练的同时,侧重对学生解题能力的培养和方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和发散思维能力。该题的关键是明确反应原理,利用好原子守恒即可。
本题难度:一般