微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 设C+CO2?2CO-Q1,反应速率v1;N2+3H2?2NH3+Q2反应速率v2.对于上述反应,当温度升高时,v1和v2的变化情况为( )
A.同时增大
B.同时减小
C.v1增大,v2减小
D.v1减小,v2增大
参考答案:升高温度时,活化分子的百分数增大,正逆反应速率都增大,吸热反应或放热反应的速率都增大,与吸放热无关.
故选A.
本题解析:
本题难度:简单
2、填空题 (4分)在一定温度下将2 mol A和2 mol B两种气体混合于2 L密闭容器中,发生如下反应:3A(g)+B(g) 2C(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8 mol D,请填写下面空白。
2C(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8 mol D,请填写下面空白。
(1)用D表示的平均反应速率为______。
(2) 若开始时只加C和D各4/3 mol,要使平衡时各物质的质量分数与原平衡相等,则还应加入_____ mol B物质。
参考答案:(4分)(1)0.2 mol·L-1·min-1 ?(2)4/3
本题解析:(1)反应速率通常用单位时间内浓度的变化量来表示,所以D的反应速率是
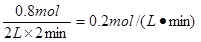 。
。
(2)由于容积不变,所以要满足平衡等效,则换算后的A、B的物质的量都等于0.2mol。C和D各4/3 mol,则相当于A、B是2mol和2/3mol,所以还需要B是2mol-2/3mol=4/3mol。
本题难度:一般
3、计算题 在有催化剂存在的容积可变容器中,保持恒温恒压下,进行如下反应:N2+3H2 2NH3。已知加入1 mol N2和4 mol H2时,达到平衡后生成a mol NH3。在相同条件下,保持平衡时各组分的百分含量不变,对①~③状态填空:
2NH3。已知加入1 mol N2和4 mol H2时,达到平衡后生成a mol NH3。在相同条件下,保持平衡时各组分的百分含量不变,对①~③状态填空:
?
| 起始状态物质的量/mol
| 平衡时NH3的物质的量/mol
|
N2
| H2
| NH3
|
已知
| 1
| 4
| 0
| a
|
①
| 1.5
| 6
| 0
| ?
|
②
| ?
| ?
| 1
| 0.5a
|
③
| m
| n
| ?
| ?
参考答案:①1.5a?②00.5?③2(n-4m)(n-3m)a
本题解析:由于起始 (N2)∶n(H2)=1∶4,则当起始以1 mol NH3通入时,达到相同的平衡状态时,须通入0.5 mol的H2;若起始通入m mol N2和n mol H2,并通入x mol NH3,则有:
N2? +? 3H2 ?2NH3 ?2NH3
①起始:1? 4? 0
平衡:? 1-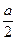 ? 4- ? 4- a? a a? a
转化:?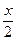 ? ? x? x x? x
②起始:(m+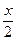 )∶(n+ )∶(n+ x)=1∶4, x)=1∶4,
所以x=2(n-4m)。
由于平衡时n(NH3)∶n始(N2)=a∶1,
则③平衡时n(NH3)∶[m+(n-4m)]=a∶1,
n(NH3)=a(n-3m)。
本题难度:简单
4、实验题 (1)Zn粒和稀盐酸反应一段时间后,反应速率会减慢,当加热或加入浓盐酸后,反应速率明显加快。由此判断,影响化学反应速率的因素有?和?。
(2)为探究锌与盐酸反应过程的速率变化,某同学的实验测定方法是:在100ml稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(氢气体积已换算为标准状况):
时间/min
| 1
| 2
| 3
| 4
| 5
| 体积/mL
| 50
| 120
| 232
| 290
| 310
|
?
①哪一时间段反应速率最大?(填“0~1 min”或“1~2 min”或“2~3 min”或“3~4 min”或“4~5min”)。
②2~3 min时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变)为?。
③试分析1~3min时间段里,反应速率变大的主要原因??。
参考答案:(8分)(1)温度 (1分)?浓度 (1分)(2)①2~3min反应速率最大(2分)
②0.1mol.L-1.min-1?(2分)? ③反应放热成为影响速率的主要因素。(2分)
本题解析:(1)Zn粒和稀盐酸反应一段时间后,反应速率会减慢,当加热或加入浓盐酸后,反应速率明显加快。由此判断,影响化学反应速率的因素有温度和浓度。
(2)①根据表中数据可知0~1 min、1~2 min、2~3 min、3~4 min、4~5min内生成氢气的体积(ml)分别是50、70、112、58、20,所以2~3min反应速率最大。
②2~3 min时间段内删除氢气的物质的量是0.112L÷22.4/mol=0.005mol,所以消耗盐酸的物质的量是0.01mol,其浓度是0.01mol÷0.1L=0.1mol/L,因此以盐酸的浓度变化来表示的该反应速率0.1mol/L÷1min=0.1mol.L-1.min-1。
③因为反应放热,随着反应的进行,溶液的温度越来越高,温度成为影响速率的主要因素。
点评:该题是基础性试题的考查,难度不大。明确反应速率的含义、计算依据以及影响反应速率的因素是答题的关键,有利于培养学生的逻辑思维能力和发散思维能力,有助于提升学生的学科素养。
本题难度:一般
5、选择题 已知4NH3(g)+5O2(g)═4NO(g)+6H2O(g),若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确的关系式为( )
A.4v(NH3)=5v(O2)
B.5v(O2)=6v(H2O)
C.2v(NH3)=3v(H2O)
D.4v(O2)=5v(NO)
参考答案:同一化学反应、同一时间段内,各物质的反应速率之比等于计量数之比.
A、V(NH3):V(O2)=4:5,5V(NH3)=4V(O2),故A错误.
B、V(O2):V(H2O)=5:6,6V(O2)=5V(H2O),故B错误.
C、V(NH3):V(H2O)=4:6=2:3,3V(NH3)=2V(H2O),故C错误.
D、V(O2):V(NO)=5:4,4V(O2)=5V(NO),故D正确.
故选D.
本题解析:
本题难度:简单
|