微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 研究性学习小组查阅资料得知,漂白粉与硫酸反应可以制得氯气,化学方程式为:Ca(ClO)2+CaCl2+2H2SO4
2CaSO4+2Cl2↑+2H2O.他们设计了如下制取氯气并验证其性质的实验.
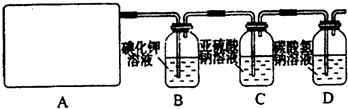
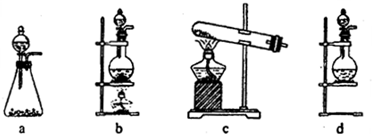
试回答:(1)该实验中A部分的装置是______(填写装置的序号).
(2)(1)选项中d装置的两个主要的玻璃器皿的名称分别是______、______.
(3)请你设计一个实验,证明洗气瓶C中的Na2SO3已经被氧化(简述实验步骤):______.
(4)分别写出C装置、D装置发生反应的离子方程式______.
(5)该实验存在明显的缺陷,请你从化学反应的视角提出改进的方法是______.所发生反应的化学方程式是______.
(6)该小组又进行了如下实验:称取漂白粉2.0g,研磨后溶解,配制成250mL溶液,取25mL加入到锥形瓶中,再加入过量的KI溶液和过量的H2SO4溶液,静置.待完全反应后,用0.1mol/L的Na2S2O3溶液作标准溶液滴定反应生成的碘,已知反应方程式为:
2Na2S2O3+I2═Na2S4O6+2NaI?反应完成时,共用去Na2S2O3?20.0mL.则该漂白粉中Ca(ClO)2的质量分数为______.(保留至0.01%)
参考答案:(1)A部分用于制取Cl2,根据所给Cl2的生成反应的反应物状态和反应是否需要加热选择气体发生装置,应选属于“固+液?△?.?气”型的b,故答案为:b;
(2)d装置的两个主要的玻璃器皿为圆底烧瓶和分液漏斗,故答案为:分液漏斗;圆底烧瓶;
(3)Na2SO3氧化的产物为Na2SO4,确定存在SO42-即可证明Na2SO3已部分被氧化.检验时,应取C中溶液少许于洁净试管中,先加稀HCl至不再产生气体以排除SO32-的干扰,然后再加入BaCl2溶液,若产生白色沉淀,则证明Na2SO3已部分被氧化,
故答案为:取少量溶液置于洁净的试管中,向其中滴加稀盐酸至不再产生气体,再向其中滴入氯化钡溶液,若产生白色沉淀,证明亚硫酸钠被氧化;
(4)C装置中是氯气通入亚硫酸钠溶液中发生的反应,亚硫酸钠具有还原性被氯气氧化为硫酸钠,反应的两种方程式为:Cl2+H2O+SO32ˉ=SO42ˉ+2Clˉ+2H+;进入D的Cl2与水反应的离子方程式为Cl2+H2O?H++Cl-+HClO,HCl能与NaHCO3反应,离子方程式为H++HCO3-=CO2↑+H2O,HClO因酸性比H2CO3弱而不能与NaHCO3反应,Cl2+H2O═H++Cl-+HClO;H++HCO3-═CO2↑+H2O;或HCO3ˉ+Cl2=HClO+CO2↑+Cl-,
故答案为:Cl2+H2O+SO32ˉ=SO42ˉ+2Clˉ+2H+;Cl2+H2O═H++Cl-+HClO;H++HCO3-═CO2↑+H2O;或HCO3ˉ+Cl2=HClO+CO2↑+Cl-;
(5)NaHCO3吸收Cl2的能力有限,在D装置后增加一个尾气吸收装置,应将尾气通入NaOH溶液中,反应的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,
故答案为:在D装置后增加一个尾气吸收装置,应将尾气通入NaOH溶液中;Cl2+2NaOH=NaCl+NaClO+H2O;
(5)关系式Ca(ClO)2~2Cl2~2I2~4Na2S2O3,
n[Ca(ClO)2]=14n(Na2S2O3)=20.0 mL×10-3 L?mL-1×0.1 mol?L-1×250ml25ml=0.005 mol,
Ca(ClO)2%=0.005mol×143g/mol2.0g×100%=35.75%,
故答案为:35.75%.
本题解析:
本题难度:一般
2、选择题 化学与环境、生产和生活密切相关,下列说法正确的是( )
A.腌制熟食品时,添加少量亚硝酸钠,是为了使其昧道更加美味可口
B.在煤中加入适量CaSO4,可大大减少燃烧产物中SO2的量
C.卫生部公告2011年5月1日起全面叫停面粉增白剂,由此可知:应当严格禁止在食品中使用任何食品添加剂
D.用氯气给自来水消毒可能生成对人体有害的有机氯化物
参考答案:A、腌制熟食品时,添加少量亚硝酸钠,是为了防止食物腐败变质,故A错误;
B、在煤中加入适量CaSO4,不和二氧化硫反应,不会减少燃烧产物中SO2的量,故B错误;
C、所有食物中均含有食品添加剂,只要添加剂不超量,对人体是无害的,故C错误;
D、氯气和水的反应过程中可以产生高活性的氯自由基Cl?,它能够与有机物反应生成有机氯化物,故D正确.
故选D.
本题解析:
本题难度:简单
3、实验题 请利用下列装置及试剂组装一套装置。
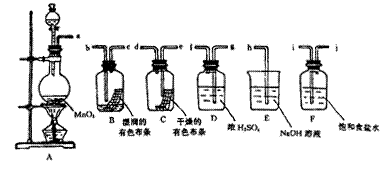
其流程是,先制取纯净干燥的Cl2 (不收集),后试验干燥的Cl2和潮湿的Cl2有无漂白性。
(不收集),后试验干燥的Cl2和潮湿的Cl2有无漂白性。
(1)按气体从左向右流向将各装置依次连接起来(填字母序号):
a接? ____ _? __?___?接h 。
(2)烧瓶中发生反应的化学方程式是?。
(3)E装置的作用是?,F装置的作用是?。
(4)C瓶中的现象是?,B瓶中的现象是?。以上事实说明起漂白作用的物质是?。
参考答案:(1)ijgfedbc(2分)(2)MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O(2分)
MnCl2+Cl2↑+2H2O(2分)
(3)吸收多余的氯气防止污染空气(1分)?除去Cl2中HCl气体(1分)
(4)有色布条不褪色?有色布条褪色?次氯酸(HClO)(每空1分)
本题解析:略
本题难度:一般
4、计算题 不同卤素的原子互相可以共用电子对形成一系列化合物,这类化合物叫卤素互化物,现将4.66 g BrCln溶于水,再通入过量SO2,使其发生如下反应:BrCln+(n+1)H2O+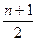 SO2====HBr+nHCl+
SO2====HBr+nHCl+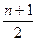 H2SO4
H2SO4
待反应完全后将所得溶液调至中性,再加入过量Ba(NO3)2溶液可生成11.65 g沉淀,试确定BrCln中的n值。
参考答案:n=3
本题解析:n(BaSO4)="0.05" mol
n(H2SO4)="0.05" mol
BrCln?—?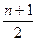 H2SO4
H2SO4
(80+35.5n)g 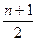 mol
mol
4.66 g? 0.05 mol
n=3
本题难度:简单
5、填空题 变色眼镜的玻璃镜片内含有少量溴化银和微量氧化铜.当玻璃受到阳光照射时,因为发生_________反应(用化学方程式表示,下同),而使玻璃由无色变成灰黑色.把玻璃放到暗处,又因为发生_________反应,而使玻璃又变成无色透明,在这个变化过程中,CuO的作用是______________________________________________________.
参考答案:2AgBr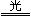 2Ag+Br2?2Ag+Br2="===2AgBr?" 催化剂
2Ag+Br2?2Ag+Br2="===2AgBr?" 催化剂
本题解析:利用AgBr的光敏性,见光分解:2AgBr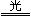 2Ag+Br2;暗处在CuO作用下,Ag跟Br2反应生成AgBr,2Ag+Br2====2AgBr.
2Ag+Br2;暗处在CuO作用下,Ag跟Br2反应生成AgBr,2Ag+Br2====2AgBr.
本题难度:一般