| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点归纳《化学平衡常数》高频考点特训(2017年练习版)(四)
 参考答案:AD 本题解析: 本题难度:一般 4、简答题 Ⅰ、CO和H2的混合气体俗称合成气,是一种重要的工业原料气,焦炭、天然气(主要成分为CH4)、重油、煤在高温下均可与水蒸气反应制得合成气.
(2)向体积为2L的密闭容器中充入CH4和H2O(g)组成的混合气(共1mol),在一定条件下发生反应,并达到平衡状态,测得温度、压强、投料比X〔
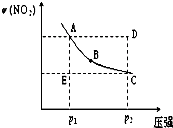
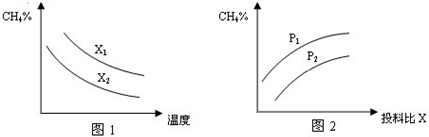 ①图1中的两条曲线所示投料比的关系X2______X1(填“=”“>”或“<”下同) ②图2中两条曲线所示的压强比的关系:P2______P1 (3)以CH4、O2为原料可设计成燃料电池: ①设装置中盛有150.0mL1.0mol/LKOH溶液,放电时参与反应的氧气在标准状况下的体积为4.48L,放电过程中转移电子的物质的量为______. ②以H2SO4溶液代替KOH溶液为电解质溶液,则燃料电池的负极反应式为:______. Ⅱ、(1)有一种用CO2生产甲醇燃料的方法: 已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-akJ?mol-1; CH3OH(g)═CH3OH(l)△H=-bkJ?mol-1; 2H2(g)+O2(g)═2H2O(g)△H=-ckJ?mol-1; H2O(g)═H2O(l)△H=-dkJ?mol-1, 则表示CH3OH(l)燃烧热的热化学方程式为:______. (2)已知某温度下Mg(OH)2的Ksp=6.4xl0-12,当溶液中c(Mg2+)≤1.0×10-5mol?L-1可视为沉淀完全,则应保持溶液中c(OH-)≥______mol?L-1. 参考答案:Ⅰ、(1)平衡表达式为:K=c(H2)?c(CO)c(H2O),生成物为CO、H2,反应物含有H2O,三者化学计量数分别为1、1、1,根据元素守恒,故另一反应物为固体C,反应中它所对应反应的化学方程式为C(s)+H2O(g)?CO(g)+H2(g), 本题解析: 本题难度:一般 5、填空题 氮是地球上含量丰富的一种元素,氮元素的单质及其化合物在工农业生产、生活中有着重要作用。 ①该反应的平衡常数表达式:K= _____________ 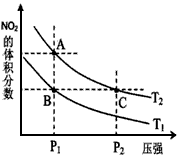 a.A、C两点的反应速率:A>C b.A、C两点的化学平衡常数:A>C c.A、C两点N2O4的转化率:A>C d.由状态B到状态A,可以用加热的方法 (4)一定温度下,在1L密闭容器中充入1molN2和3molH2并发生反应。若容器容积恒定,10min达到平衡时,气体的总物质的量为原来的7/8,则N2的转化率a(N2)=___________ , 以NH3表示该过程的反应速率v(NH3)=_____________。 参考答案:(1)NO2(g) + CO(g) = NO(g) + CO2(g) △H = -234KJ/mol 本题解析: 本题难度:一般 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学必备知识点《化学反应速.. | |