微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (1)过氧化钠可用作于制氧剂,写出过氧化钠与二氧化碳反应的化学方程式____________。
(2)工业上制取漂白粉的化学方程式为______________。
(2)在标准状况下,33.6 L氯气的质量是________g,将红热的铁丝与其完全反应,反应的化学方程式为___________ ,最多可消耗铁的物质的量为__________mol。
参考答案:(1)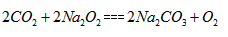
(2)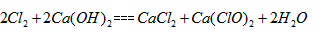
(3)106.5;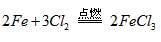 ;1
;1
本题解析:
本题难度:一般
2、选择题 下列关于N、Si、S、Cl等非金属元素化合物的说法正确的是?(?)
A.硝酸与金属反应时,硝酸越稀其还原产物中氮元素的价态越低
B.二氧化硅是制造太阳能电池板的主要材料
C.少量SO2与Na2O2反应的方程式为:2SO2+2Na2O2=2Na2SO3+O2
D.Ca(ClO)2比HClO稳定,所以漂白粉露置在空气中不会失效
参考答案:A
本题解析:A项由铜与浓硝酸和稀硝酸反应即可以证明;B项二氧化硅是制造光导纤维的主要材料,单质硅是制造太阳能电池板的主要材料;C项Na2O2能将SO2氧化生成Na2SO4;D项Ca(ClO)2能与空气中的水和二氧化碳反应而失效。
本题难度:简单
3、计算题 (5分)已知实验室制氯气的化学方程式为:MnO2?+ 4HCl (浓) = MnCl2?+ Cl2↑+2H2O,现用足量浓盐酸在加热条件下跟二氧化锰反应制取氯气。若标准状况下制得Cl22.24L求:
(1)二氧化锰的质量;
(2)把(1)中反应后的溶液稀释到50 mL,从中取出10.0 mL,加入10.0 mL 0.600 mol / L的硝酸银溶液,恰好将氯离子完全沉淀。求(1)中反应后溶液稀释到50 mL时氯离子的物质的量浓度是多少?
参考答案:(5分)?(1)8.7g(2分)?(2)0.6mol ·L-1?(3分)
本题解析:略
本题难度:一般
4、填空题 某同学设计的制取氯气和验证氯气部分化学性质的实验装置如下图甲所示:
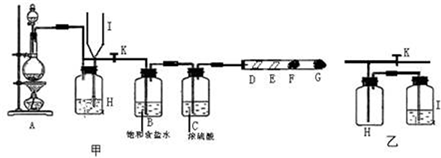
其中D处放有干燥的紫色石蕊试纸,E处放有湿润的紫色石蕊试纸,F、G处依次放有喷上少量淀粉KI溶液、浓NaOH溶液的棉球.回答下列问题:
(1)在装置A中放入有关药品后,打开活塞K,将分液漏斗中的液体加入烧瓶中,关闭分液漏斗的活塞,点燃酒精灯,请写出A处反应的离子方程式:______
(2)B处饱和食盐水是为了除去______,C处浓硫酸的作用是______.
(3)实验中可观察到颜色的变化:D处______,E处______,F处______,G处棉球的作用是______,G处反应的离子方程式______.
(4)当F处棉球变色,立即关闭活塞K,可看到I瓶中液面上升,H瓶中充满黄绿色气体,则H瓶中加入的液体一般为______;甲中H-I装置的作用为______.若将甲中的H-I装置置换为乙装置,是否可行(填“是”或“否”)______,理由是______.
参考答案:(1)A用来制备氯气,反应的离子方程式为MnO2+4H++2Cl-?△?.?Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-?△?.?Mn2++Cl2↑+2H2O;
(2)氯气难溶于饱和食盐水,而HCl易溶于水,B处饱和食盐水是为了除去HCl,浓硫酸具有吸水作用,C处浓硫酸的作用是干燥氯气,故答案为:HCl;干燥氯气;
(3)干燥的氯气不具有漂白性,氯气与水反应生成盐酸和次氯酸,次氯酸具有漂白性,氯气与KI反应生成单质碘,氯气有毒,不能直接排放到空气中,应用NaOH溶液吸收,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:不变色;先变红,后褪色;变蓝;吸收多余的氯气;Cl2+2OH-=Cl-+ClO-+H2O;
(4)氯气难溶于饱和食盐水,甲中H-I装置可用来收集氯气,但不能用乙装置,原因是密闭装置,气体压力大时易爆炸,
故答案为:饱和食盐水;收集氯气;否;密闭装置,气体压力大时易爆炸.
本题解析:
本题难度:一般
5、选择题 下列关于新制氯水和久置氯水的说法中不正确的是( )
A.新制氯水呈黄绿色,久置氯水无色
B.新制氯水漂白能力强,而久置的氯水几乎无漂白作用
C.新制的氯水所含微粒种类多,而久置氯水所含微粒种类少
D.新制的氯水中无氯离子,而久置的氯水中则含有氯离子
参考答案:A.因新制氯水中含氯气,所以新制氯水呈黄绿色,久置氯水中无氯气分子,所以呈现无色,故A正确;
B.新制氯水中含次氯酸,次氯酸具有强氧化性,具有漂白作用,久置氯水中无次氯酸,无漂白作用,故B正确;
C.新制氯水中存在的微粒:三分子:Cl2、HClO、H2O,四离子:H+、Cl-、ClO-、OH-,久置氯水含有H2O、H+、Cl-、OH-,故C正确;
D.新制氯水和久置氯水都含氯离子,故D错误.
故选D.
本题解析:
本题难度:简单