微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 已经知25℃时几种物质的电离度(溶液浓度为0.1mol)如下表:

(已知(H2SO4的第一步是完全电离的)
(1)25℃时,0.1mol/L上述几种溶液[H+]由大到小的顺序是(填序号)____;
(2)25℃时,pH值相同的上述几种溶液,其物质的量浓度由大到小的顺序是____;
(3)25℃时,将足量的 Zn粉放入等体积、pH=1的上述几种溶液中产生氢气的体积(同温同压下),由大到小顺序为____;

参考答案:(1)①④②③
(2)③②④①
(3)③②①④
(4)HSO4-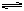 H++SO42-,H2SO4第一步电离产生的 H+能使HSO4-的电离平衡向左移动,抑制了HSO4-的电离,而NaHSO4中的HSO4-则无这种作用,因此其电离度大。</PGN0067A.TXT/PGN>
H++SO42-,H2SO4第一步电离产生的 H+能使HSO4-的电离平衡向左移动,抑制了HSO4-的电离,而NaHSO4中的HSO4-则无这种作用,因此其电离度大。</PGN0067A.TXT/PGN>
本题解析:(1)对上述四种溶液,均为0.1mol/L时,H2SO4=H++HSO4-,HSO4-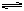 H++SO42-,所以其[H+]=0.1+0.1×10%=0.11(mol/L),NaHSO4中的[H+]=0.1×0.29=0.029mol/L,CH3COOH中的[H+]=0.1×0.0133=1.33×10-3mol/L而HCl中的[H+]=0.1×100%= 0.1mol/L
H++SO42-,所以其[H+]=0.1+0.1×10%=0.11(mol/L),NaHSO4中的[H+]=0.1×0.29=0.029mol/L,CH3COOH中的[H+]=0.1×0.0133=1.33×10-3mol/L而HCl中的[H+]=0.1×100%= 0.1mol/L
∴顺序为①④②③
(2)25℃,pH值相同的四种溶液,[H+]浓度相同,其电离度越小,该电解质溶液的浓度越大,所以应为:③②④①,其中H2SO4的浓度最小,是因为它的第一步完全电离与HCl相同,但其第二步又可电离出一定的H+,所以二者综合,其浓度最小。
(3)在等体积,[H+]浓度相同的情况下,加入足量的Zn粉,将产生氢气的量与各电解质的浓度有关,因该反应可进行到底,溶液浓度越大,则溶质的物质的量越大,产生H2越多,但对H2SO4和HCl而言,其pH都为1,盐酸浓度要比H2SO4大;但反应中,盐酸完全消耗,而H2SO4为二元酸,第一步完全电离,第二步也在与Zn反应中趋于完全进行,所以[H+]浓度在反应中增加,产生的氢气量比盐酸多,顺序为③②①④。
本题难度:一般
2、选择题 足量镁粉与一定量的盐酸反应,由于反应速率太快,为减慢反应速率,但并不影响氢气产生的总量,可以加入下列物质中的( )
A.MgO
B.NaOH
C.K2CO3
D.CH3COONa
参考答案:根据发生的反应为Mg+2H+═Mg2++H2↑,则减小氢离子的浓度而不改变氢离子的物质的量即可满足减慢反应速率,但又不影响产生氢气的总量,
A、氧化镁和酸反应生成氯化镁和水,影响氢气的生成,故A错误;
B、加入NaOH,发生酸碱中和反应,减少氢气的生成,故B错误;
C、加入K2CO3固体,与盐酸反应生成二氧化碳,减少氢气的生成,C错误;
D、加入CH3COONa,与盐酸反应生成醋酸,氢离子浓度减小而不改变氢原子子的总物质的量即可满足减慢反应速率,但又不影响产生氢气的总量,故D正确;
故选:D.
本题解析:
本题难度:一般
3、填空题 在一定温度下,冰醋酸加水稀释过程中溶液的导电能力如下图所示,请回答:
⑴“O”点导电能力为0的理由是:?。
⑵a、b、c三点溶液中,[H+]由小到大的顺序是:?。
⑶a、b、c三点溶液中,醋酸的电离程度最大的是:?。
⑷若使c点溶液中[CH3COO-]增大,而[H+]减小,可采取的措施主要有:①?;②?;③?;④?。
参考答案:⑴冰醋酸未电离,其中没有自由移动的离子;⑵c<a<b;⑶c;⑷①CH3COOH;②NaOH;③Na2CO3;④Mg。
本题解析:⑴冰醋酸未电离,其中没有自由移动的离子;⑵导电能力越强,自由移动的离子浓度越大,故[H+]由小到大的顺序是c<a<b;⑶随着加水的量的增加,将促进醋酸的电离,故c点醋酸的电离程度最大;⑷使醋酸溶液中的CH3COO-溶液增大,可加入物质与H+反应使醋酸电离平衡向电离的方向移动,如氢氧化钠、碳酸钠及金属镁;而加入醋酸钠,虽使醋酸电离平衡向左移动,但剩余的CH3COO-的浓度仍是增加的,所以加入醋酸钠也符合题意。
本题难度:一般
4、选择题 将pH=2的盐酸和pH=2的醋酸溶液分别用蒸馏水稀释相等的倍数,稀释之后两溶液的pH大小
[? ]
A.前者大
B.后者大
C.相等
D.无法确定
参考答案:A
本题解析:
本题难度:一般
5、选择题 室温下向10mL pH=3的醋酸溶液中加入水稀释后,下列说法错误的是(?)
A.溶液中导电粒子的数目增加
B.溶液中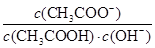 不变
不变
C.醋酸的电离程度增大,但电离平衡常数Ka不变
D.再加入10 mL pH=11的NaOH溶液,恰好完全中和
参考答案:D
本题解析:在醋酸溶液存在电离平衡:CH3COOH CH3COO-+H+ A。若加入水,则c(CH3COO-)、c(CH3COOH)、c(H+)的浓度都减小。由于电离产生的离子的浓度减小的多,所以电离平衡正向移动。所以溶液中导电粒子的数目增加。正确。B。因此c(CH3COOH)减小的倍数大于c(CH3COO-)或c(H+)减小的倍数。在溶液中还存在水的大量平衡:H2O
CH3COO-+H+ A。若加入水,则c(CH3COO-)、c(CH3COOH)、c(H+)的浓度都减小。由于电离产生的离子的浓度减小的多,所以电离平衡正向移动。所以溶液中导电粒子的数目增加。正确。B。因此c(CH3COOH)减小的倍数大于c(CH3COO-)或c(H+)减小的倍数。在溶液中还存在水的大量平衡:H2O H++OH-。在溶液中存在水的离子积常数,它只与温度有关,而与浓度等无关。因此c(H+)·c(OH-)=Kw.c(H+)减小的倍数与c(OH-)增大的倍数相同。所以溶液中
H++OH-。在溶液中存在水的离子积常数,它只与温度有关,而与浓度等无关。因此c(H+)·c(OH-)=Kw.c(H+)减小的倍数与c(OH-)增大的倍数相同。所以溶液中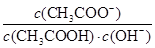 不变。正确。C.加水稀释,电离平衡正向移动,醋酸的电离程度增大,但由于温度不变,所以电离平衡常数Ka不变。正确。D.醋酸是弱酸部分电离。c(CH3COOH)>> c(H+)=10-3mol/L.若再加入10 mL pH=11的NaOH溶液,将电离的部分完全中和,由于在溶液中还存在电离未电离的电解质分子,所以破坏了醋酸的电离,平衡,醋酸会减小电离直至达到新的平衡。错误。
不变。正确。C.加水稀释,电离平衡正向移动,醋酸的电离程度增大,但由于温度不变,所以电离平衡常数Ka不变。正确。D.醋酸是弱酸部分电离。c(CH3COOH)>> c(H+)=10-3mol/L.若再加入10 mL pH=11的NaOH溶液,将电离的部分完全中和,由于在溶液中还存在电离未电离的电解质分子,所以破坏了醋酸的电离,平衡,醋酸会减小电离直至达到新的平衡。错误。
本题难度:一般