| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学必备知识点《碳族元素》试题预测(2017年最新版)(五)
(2)工业上用石英砂和焦炭可制得粗硅。 已知: 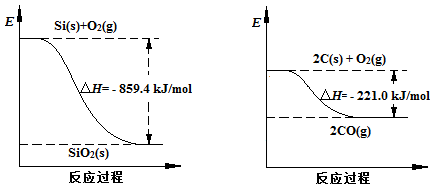 请将以下反应的热化学方程式补充完整: SiO2(s) + 2C(s) ="==" Si(s) + 2CO(g)?△H = ________ (3)粗硅经系列反应可生成硅烷(SiH4),硅烷分解生成高纯硅。已知硅烷的分解温度远低于甲烷,用原子结构解释其原因:_________,Si元素的非金属性弱于C元素,硅烷的热稳定性弱于甲烷。 (4)将粗硅转化成三氯氢硅(SiHCl3),进一步反应也可制得高纯硅。 ①SiHCl3中含有的SiCl4、AsCl3等杂质对晶体硅的质量有影响。根据下表数据,可用________ 方法提纯SiHCl3。
 Si(s) + 3HCl(g), 不同温度下,SiHCl3的平衡转化率随反应物的投料比(反应初始时,各反应物的物质的量之比)的变化关系如右图所示。下列说法正确的是________(填字母序号)。 Si(s) + 3HCl(g), 不同温度下,SiHCl3的平衡转化率随反应物的投料比(反应初始时,各反应物的物质的量之比)的变化关系如右图所示。下列说法正确的是________(填字母序号)。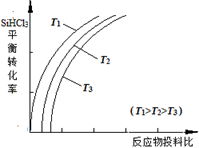 a.该反应的平衡常数随温度升高而增大 b.横坐标表示的投料比应该是 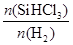 c.实际生产中为提高SiHCl3的利用率,应适当升高温度 ③整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式:____________________。 2、填空题 硅在地壳中的含量较高,硅及其化合物的开发由来已久,在现代生活中有广泛应用。回答下列问题:
(4)还原炉中发生的化学反应为:?。 (5)氯碱工业可为上述工艺生产提供部分原料,这些原料是?。 3、填空题 (6分)用地壳中某主要元素生产的多种产品在现代高科技中占有重要位置,足见化学对现代物质文明的重要作用。例如: 4、计算题 将一含SiO2杂质的石灰石样品100g加强热反应后,质量变为60.4 g。试计算: 5、选择题 将下列反应所产生的气体,通入硅酸钠溶液中后不发生反应的是(?) |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学必备知识点《弱电解质电.. | |