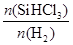|
高中化学必备知识点《碳族元素》试题预测(2017年最新版)(六)
2017-07-10 18:55:48
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (15分)高纯晶体硅是信息技术的关键材料。
(1)硅元素位于周期表的______周期______族。下面有关硅材料的说法中正确的是__________(填字母)。
A.碳化硅化学性质稳定,可用于生产耐高温水泥
B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承
C.高纯度的二氧化硅可用于制造高性能通讯材料———光导纤维
D.普通玻璃是由纯碱、石灰石和石英砂制成的,故在玻璃尖口点燃H2时出现黄色火焰
| E.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
(2)工业上用石英砂和焦炭可制得粗硅。
已知:
请将以下反应的热化学方程式补充完整:
SiO2(s) + 2C(s) ="==" Si(s) + 2CO(g)?△H = ________
(3)粗硅经系列反应可生成硅烷(SiH4),硅烷分解生成高纯硅。已知硅烷的分解温度远低于甲烷,用原子结构解释其原因:_________,Si元素的非金属性弱于C元素,硅烷的热稳定性弱于甲烷。
(4)将粗硅转化成三氯氢硅(SiHCl3),进一步反应也可制得高纯硅。
①SiHCl3中含有的SiCl4、AsCl3等杂质对晶体硅的质量有影响。根据下表数据,可用________ 方法提纯SiHCl3。
物质
| SiHCl3
| SiCl4
| AsCl3
| 沸点/℃
| 32.0
| 57.5
| 131.6
|
②用SiHCl3制备高纯硅的反应为SiHCl3(g) +H2(g)  Si(s) + 3HCl(g), 不同温度下,SiHCl3的平衡转化率随反应物的投料比(反应初始时,各反应物的物质的量之比)的变化关系如右图所示。下列说法正确的是________(填字母序号)。 Si(s) + 3HCl(g), 不同温度下,SiHCl3的平衡转化率随反应物的投料比(反应初始时,各反应物的物质的量之比)的变化关系如右图所示。下列说法正确的是________(填字母序号)。
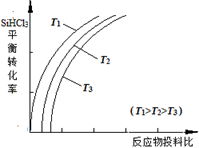
a.该反应的平衡常数随温度升高而增大
b.横坐标表示的投料比应该是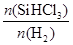
c.实际生产中为提高SiHCl3的利用率,应适当升高温度
③整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式:____________________。
参考答案:(1)3(1分)?ⅣA (1分)? BCD(2分)
(2)+638.4 kJ·mol-1(2分) (单位写错扣1分)
(3)C和Si最外层电子数相同(或“是同主族元素”) (2分),C原子半径小于Si(或“C原子电子层数少于Si”) (2分)
(4)①蒸馏(或分馏) (1分)?②a、c(2分)
③SiHCl3+3H2O===H2SiO3↓+H2↑+3HCl↑(2分)
本题解析:(1) 硅元素位于周期表的3周期ⅣA族。碳化硅化学性质稳定,可耐高温,但不可能做水泥,A错;盐酸不能与硅反应,应采用氢氟酸为抛光液抛光单晶硅,E错。
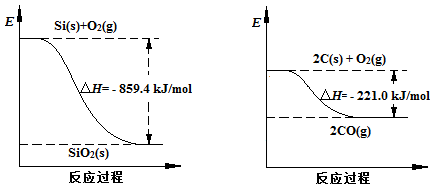
(2)根据两个反应过程能量变化图像可知:Si(s) + O2(s) ="==" SiO2(s)?△H=-859.4kJ·mol-1
2C(s) + O2(s)===2CO(g)?△H =-221.0kJ·mol-1
用第二个方程式减去第一个方程式得出所需反应,可以计算出△H =+638.4 kJ·mol-1。
(3) 硅烷的分解温度远低于甲烷,是因为C和Si最外层电子数相同(或“是同主族元素”),C原子半径小于Si(或“C原子电子层数少于Si”)
(4)①SiHCl3中含有的SiCl4、AsCl3等杂质,而SiHCl3沸点最低,可采用蒸馏(或分馏)提纯;②a项中,因为反应投料比相同时,温度越高,SiHCl3的转化率越大,说明正反应是吸热反应,故该反应的平衡常数随温度升高而增大;b项中,反应投料比最大,同一温度曲线,SiHCl3的转化率越大,只有加入H2的量才能实现,说明横坐标表示的投料比应该是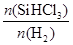 ;c项中,SiHCl3沸点低,实际生产中为提高SiHCl3的利用率,应适当升高温度。 ;c项中,SiHCl3沸点低,实际生产中为提高SiHCl3的利用率,应适当升高温度。
③根据质量守恒定律,可确定产物中H元素不守恒,即添加H2,有SiHCl3+3H2O="==" H2SiO3↓+H2↑+3HCl↑
本题难度:困难
2、填空题 硅在地壳中的含量较高,硅及其化合物的开发由来已久,在现代生活中有广泛应用。回答下列问题:
(1)陶瓷、水泥和玻璃是常用的传统的无机非金属材料,其中生产普通玻璃的主要原料有?。
(2)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:

①工业上用石英砂和焦炭在电弧炉中高温加热到1600℃-1800℃除生成粗硅外,也可以生产碳化硅,则在电弧炉内可能发生的反应的化学方程式为?。
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,粗硅生成SiHCl3的化学反应方程式?。
(3)有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和?;SiHCl3极易水解,其完全水解的产物为?。
物质
| Si
| SiCl4
| SiHCl3
| SiH2Cl2
| SiH3Cl
| HCl
| SiH4
| 沸点/℃
| 2355
| 57.6
| 31.8
| 8.2
| -30.4
| -84.9
| -111.9
|
?
(4)还原炉中发生的化学反应为:?。
(5)氯碱工业可为上述工艺生产提供部分原料,这些原料是?。
参考答案:(1)石英砂、纯碱和石灰石(2分)
(2)①SiO2 + 2C Si + 2CO↑(2分)、SiO2 + 3C Si + 2CO↑(2分)、SiO2 + 3C SiC + 2CO↑(2分) SiC + 2CO↑(2分)
②Si + 3HCl SiHCl3 + H2(2分) SiHCl3 + H2(2分)
(3)蒸馏(1分)? H4SiO4(或H2SiO3)、H2、HCl(2分,答不全,少一种扣一分,但有错不给分)
(4)SiHCl3 + H2 ?Si + 3HCl (2分) ?Si + 3HCl (2分)
(5)H2、HCl(2分)
本题解析:(1)生产普通玻璃的主要原料有石英砂、纯碱和石灰石
(2)①石英砂的主要成分是SiO2,与C可能的反应有:SiO2 + 2C Si + 2CO↑、SiO2 + 3C Si + 2CO↑、SiO2 + 3C SiC + 2CO↑ SiC + 2CO↑
②粗硅生成SiHCl3的化学反应方程式为Si + 3HCl SiHCl3 + H2 SiHCl3 + H2
(3)硅的氯化物的熔点相差较大且互溶,所以采用蒸馏的方法可提纯SiHCl3,从元素的种类上分析SiHCl3完全水解的产物有H4SiO4(或H2SiO3)、H2、HCl
(4)还原炉中发生的反应是氢气还原SiHCl3,化学方程式为SiHCl3 + H2 ?Si + 3HCl ?Si + 3HCl
(5)氯碱工业的产品有H2、Cl2、NaOH,所以为上述工艺生产提供部分原料是H2、HCl
本题难度:困难
3、填空题 (6分)用地壳中某主要元素生产的多种产品在现代高科技中占有重要位置,足见化学对现代物质文明的重要作用。例如:
(1)计算机芯片的主要成分是(填化学式,以下同)?;?
(2)光导纤维的主要成分是?:
(3)目前应用最多的太阳能电池的光电转化材料是?;
参考答案:(1). Si? (2). SiO2? (3). Si
本题解析:略
本题难度:简单
4、计算题 将一含SiO2杂质的石灰石样品100g加强热反应后,质量变为60.4 g。试计算:
(1)生成是气体在标准状况下的体积。
(2)该石灰石的纯度(碳酸钙的质量分数)。
参考答案:(1)20.16L。(2)90%
本题解析:(1)根据质量守恒定律,m(CO2)=100g-60.4 g=39.6 g,n(CO2)=39.6 g÷44g/mol=0.9mol,v(CO2)=0.9mol×22.4L/mol=20.16L。
(2)n(CaCO3)=n(CO2)=0.9mol,m(CaCO3)=0.9mol×100g/mol=90g,其质量分数为90%。
本题难度:简单
5、选择题 将下列反应所产生的气体,通入硅酸钠溶液中后不发生反应的是(?)
A.CO2与Na2O2
B.Cu与浓H2SO4共热
C.Cu与浓硝酸共热
D.食盐与浓H2SO4共热
参考答案:A
本题解析:A项中气体为O2,不反应,而B项中SO2、C项中NO2、D项中HCl均与Na2SiO3反应产生H2SiO3沉淀。
本题难度:简单
| 
 Si(s) + 3HCl(g), 不同温度下,SiHCl3的平衡转化率随反应物的投料比(反应初始时,各反应物的物质的量之比)的变化关系如右图所示。下列说法正确的是________(填字母序号)。
Si(s) + 3HCl(g), 不同温度下,SiHCl3的平衡转化率随反应物的投料比(反应初始时,各反应物的物质的量之比)的变化关系如右图所示。下列说法正确的是________(填字母序号)。