|
高考化学知识点总结《影响化学反应速率的因素》高频试题特训(2017年最新版)(二)
2017-07-10 18:57:16
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法不正确的是( )
①0.1mol?L-1盐酸和0.1mol?L-1醋酸分别与0.2mol?L-1氢氧化钠溶液反应的速率相同
②0.1mol?L-1盐酸和加0.1mol?L-1硝酸分别与大小相同的大理石反应的速率不同
③大理石块与大理石粉末分别与加0.1mol?L-1盐酸反应的速率不同
④已知t0C时反应N2(g)+3H2(g) 2NH3(g)△H<0的速度为v,若降低温度,正反应速率加大
⑤合成氨中及时分离出氨气后可减小反应速率
⑥在合成氨反应中,相同条件下在有催化剂时(a)和无催化剂时(b)速率时间图象可用图一表示
⑦在合成氨反应中,不同温度下(T2>T1)的NH3的体积分数与时间的关系图象可用图二表示.
A.除①⑦外
B.除③⑤⑥外
C.除③⑤外
D.除③⑥⑦外
| 
参考答案:①0.1mol?L-1盐酸和0.1mol?L-1醋酸分别与0.2mol?L-1氢氧化钠溶液反应的速率是前这块,因为盐酸是强酸,电离出的氢离子浓度大,故①错误;
②0.1mol?L-1盐酸和加0.1mol?L-1硝酸分别与大小相同的大理石反应,实质是大理石和氢离子的反应,二者电离出的氢离子浓度相等,所以反应速率相等,故②错误;
③大理石块与大理石粉末分别与加0.1mol?L-1盐酸反应的速率是后者快,故③正确;
④已知t0C时反应N2(g)+3H2(g)?△?.?2NH3(g)△H<0的速度为v,若降低温度,正反应速率和逆反应速率均减慢,故④错误;
⑤合成氨中及时分离出氨气后,产物浓度减小,可减小反应速率,故⑤正确;
⑥在合成氨反应中,相同条件下在有催化剂时(a)比无催化剂时(b)速率块,故⑥错误;
⑦合成氨反应是放热反应,温度越低,化学反应速率越慢,达平衡用的时间长,所以T2>T1,降低温度化学平衡向着放热方向进行,即向着正方向进行,氨气的体积分数增大,故⑦错误.
故选C.
本题解析:
本题难度:一般
2、选择题 对于反应2SO2(g)+O2(g)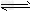 2SO3(g),能增大正反应速率的措施是 2SO3(g),能增大正反应速率的措施是
[? ]
A.通入大量的O2?
B.增大容器容积
C.移去部分SO3?
D.降低体系温度
参考答案:A
本题解析:
本题难度:一般
3、选择题 盐酸与碳酸钙固体反应时,下列措施能使最初的反应速率明显加快的是( )
A.增加碳酸钙的量
B.盐酸的用量增加一倍
C.盐酸的用量减半,浓度加倍
D.温度升高
参考答案:A、增加碳酸钙的量,并不改变浓度,反应速率不变,故A错误;
B、盐酸的用量增加一倍,并不改变浓度,反应速率不变,故B错误;
C、盐酸的用量减半,浓度加倍,反应速率加快,故C正确;
D、温度升高,化学反应速率加快,故D正确;
故选:CD.
本题解析:
本题难度:一般
4、选择题 下列化学反应,需要加快的是( )
A.食物腐败
B.塑料老化
C.炼钢
D.铁腐蚀
参考答案:A.为节约粮食,应减小食物腐败的速率,故A错误;
B.为减少资源的浪费,应减小塑料老化的速率,故B错误;
C.为提高钢的产量,满足工农业生成的需要,应提高炼钢的速率,故C正确;
D.为减少资源的浪费,应减小铁腐蚀的速率,故D错误.
故选D.
本题解析:
本题难度:简单
5、选择题 已知A2(g)+2B2(g)2AB2(g)△H<0,下列说法正确的是( )
A.升高温度,正向反应速率增加,逆向反应速率减小
B.升高温度反应速率增加,从而缩短达到平衡的时间
C.升高温度或增大压强都有利于该反应平衡正向移动
D.升高温度平衡常数K增大
参考答案:A、升高温度,化学反应速率增加,正向反应速率增加,逆向反应速率也增加,故A错误;
B、升高温度,化学反应速率增加,从而缩短达到平衡的时间,故B正确;
C、升高温度化学平衡向着吸热方向进行,即向左进行,增大压强化学平衡向着气体物质的量减小的方向进行,即向右进行,故C错误;
D、对于放反应,升高温度,化学平衡常数增大,该反应是放热反应,所以升高温度该反应的K减小,故D错误.
故选B.
本题解析:
本题难度:一般
| 