微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (14分)H2O2是一种常用绿色氧化剂,在化学研究中应用广泛。
(1)空气阴极法电解制备H2O2的装置如下图所示,主要原理是在碱性电解质溶液中,通过利用空气中氧气在阴极还原得到H2O2和稀碱的混合物。
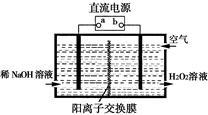
试回答:
①直流电源的a极名称是 。
②阴极电极反应式为 。
③1979年,科学家们用CO、O2和水在三苯膦钯的催化下制得了H2O2。相对于电解法,该方法具有的优点是安全、 。
(2)Fe3+对H2O2的分解具有催化作用。利用图(a)和(b)中的信息,按图(c)装置(连通的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的 (填“深”或“浅”),其原因是 。

(3)用H2O2和H2SO4的混合溶液可溶解印刷电路板金属粉末中的铜。反应的离子方程式是 ,控制其它条件相同,印刷电路板的金属粉末用10%H2O2 和3.0mol·L-1H2SO4溶液处理,测得不同温度下铜的平均溶解速率(见下表)
温度(℃)
| 20
| 30
| 40
| 50
| 60
| 70
| 80
|
Cu的平均溶解速率
(×10-3mol·min-1)
| 7.34
| 8.01
| 9.25
| 7.98
| 7.24
| 6.73
| 5.76
|
当温度高于40℃时,铜的平均溶解速率随着反应温度的升高而下降,其主要原因是 。
参考答案:(1)①正极② O2 + 2e-+ 2H2O=H2O2 + 2OH-③能耗低
(2)①深 ②H2O2分解放热,使平衡2NO2 N2O4向生成NO2方向移动
N2O4向生成NO2方向移动
(3)Cu + H2O2 +2H+=Cu2+ + 2H2O;温度升高,H2O2分解速率加快 (每空2分)
本题解析:(1)①根据装置图可知,与电源b极相连的电极产生双氧水,由于利用空气中氧气在阴极还原得到H2O2和稀碱的混合物,这说明该电极是阴极,即b是负极,则a是正极。
②电解池中阴极得到电子,发生还原反应,双氧水在阴极产生,则阴极电极反应式为O2 + 2e-+ 2H2O=H2O2 + 2OH-。
③由于电解法需要消耗大量的电能,所以该方法的另外一个优点是能耗低。
(2)由于Fe3+对H2O2的分解具有催化作用,根据图像可知而双氧水分解是放热反应,所以B瓶中溶液温度高。又因为NO2转化为N2O3是放热反应,升高温度促使平衡2NO2 N2O4向生成NO2方向移动,所以颜色深。
N2O4向生成NO2方向移动,所以颜色深。
(3)双氧水具有氧化性,在稀硫酸溶液中能把铜氧化生成硫酸铜和水,反应的离子方程式为Cu + H2O2 +2H+=Cu2+ + 2H2O。由于双氧水不稳定,受热易分解,温度过高时导致H2O2分解速率加快,因此铜的平均溶解速率随着反应温度的升高反而下降。
考点:考查电化学原理的应用、双氧水性质以及外界条件对反应速率和平衡状态的影响
本题难度:困难
2、简答题 (15分)某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】2KMnO4 + 5H2C2O4 + 3H2SO4= K2SO4 + 2MnSO4 + 10CO2↑ + 8H2O
【实验内容及记录】
实验编号
| 室温下,试管中所加试剂及其用量 / mL
| 室温下溶液颜色褪至无色所需时间 / min
|
0.6 mol/L
H2C2O4溶液
| H2O
| 3 mol/L
稀硫酸
| 0.05mol/L KMnO4溶液
|
1
| 3.0
| 2.0
| 2.0
| 3.0
| 1.5
|
2
| 2.0
| 3.0
| 2.0
| 3.0
| 2.7
|
3
| 1.0
| 4.0
| 2.0
| 3.0
| 3.9
|
请回答:
(1)根据上表中的实验数据,可以得到的结论是 。
(2)利用实验1中数据计来源:91exam .org算,若用KMnO4的浓度变化表示的反应速率为:υ(KMnO4)= 。
(3)该小组同学根据经验绘制了n(Mn2+) 随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+) 随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。

①该小组同学提出的假设是 。
②请你帮助该小组同学完成实验方案,并填写表中空白。
实验编号
| 室温下,试管中所加试剂及其用量 / mL
| 再向试管中加入少量固体
| 室温下溶液颜色褪至无色所需时间 / min
|
0.6 mol/L
H2C2O4溶液
| H2O
| 3 mol/L
稀硫酸
| 0.05 mol/L KMnO4溶液
|
4
| 3.0
| 2.0
| 2.0
| 3.0
|
| t
|
③若该小组同学提出的假设成立,应观察到的现象是 。
(4)工业上可用电解K2MnO4浓溶液的方法制取KMnO4,则电解时,阳极发生的电极反应为 ;总方程式为 。
参考答案:(1)其他条件相同时,增大H2C2O4浓度(或反应物浓度),反应速率增大(3分,每点1分)
(2)1.0×10-2 mol / (L·min) (2分)
(3) ①生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用)[2分,不指出MnSO4(或Mn2+)扣1分] ② MnSO4 (2分)
③ 与实验1比较,溶液褪色所需时间短(2分,不写“与实验1比较”扣1分) 或:所用时间(t)小于1.5min(或其他合理答案)
(4)2MnO42--2e-=2MnO4-(或 MnO42--e-=MnO4- ) (2分);
2K2MnO4+2H2O电解2KMnO4+2KOH+H2↑(2分)
本题解析:(1)根据表中数据可知,其他条件相同时,增大H2C2O4浓度(反应物浓度),反应速率增大。
(2)反应中消耗高锰酸钾的浓度是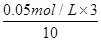 =0.015mol/L,所以υ(KMnO4)=0.015mol/L÷1.5min=1.0×10-2 mol / (L·min)。
=0.015mol/L,所以υ(KMnO4)=0.015mol/L÷1.5min=1.0×10-2 mol / (L·min)。
(3)①由图2可知反应开始后速率增大的比较快,说明生成物中的MnSO4(或Mn2+)为该反应的催化剂.
②要验证假设作对比实验与与实验1比较,其它条件相同时加入MnSO4即可。
③如果假设成立,则加入硫酸锰以后若反应加快,溶液褪色的时间小于1.5min,说明Mn2+是催化剂.
(4)K2MnO4制取KMnO4,反应过程中Mn元素的化合价从+6价升高到+7价,因此锰酸钾在阳极放电,电极反应式为MnO42--e-=MnO4-,阴极是溶液中的氢离子放电产生氢气,所以总反应式为2K2MnO4+2H2O电解2KMnO4+2KOH+H2↑。
考点:考查反应速率计算、外界条件对反应速率的影响以及电解原理的应用
本题难度:一般
3、填空题 (5分)用纯净的锌粒与稀盐酸反应制取氢气气体,请回答:
(1)实验过程如下图所示,分析判断________段化学反应速率最快,_______段收集的氢气最多。这段反应速率最快的原因是??。

(2)为了减缓上述反应的速率,欲向溶液中加入下列物质,你认为可行的是(?)
A.蒸馏水
B.氯化钠固体
C.氯化钠溶液
D.浓盐酸
 ?Si(s) + 4HCl(g) △H>0,下列措施能提高反应速率且使平衡向正反应方向移动的是
?Si(s) + 4HCl(g) △H>0,下列措施能提高反应速率且使平衡向正反应方向移动的是