微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (每空1分,共6分)下面是某科学兴趣小组的同学做同周期元素性质递变规律实验时,设计的一套实验方案。其中实验步骤如下:
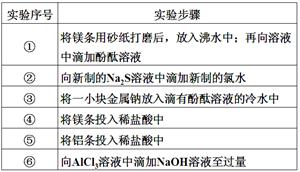
请整理并完成实验报告:
(1)实验目的:?。
(2)实验用品:
试剂:金属钠、镁条、铝条、稀盐酸、新制氯水、新制Na2S溶液、AlCl3溶液、NaOH溶液等。
仪器:?、酒精灯、表面皿、试管夹、镊子、小刀、玻璃片、砂纸等。
(3)实验内容(完成下列表格中的未完成的实验现象和化学方程式):
实验序号
| 实验现象
| 化学方程式
|
①
| 有气体产生,溶液变成浅红色
| ?
|
②
| 生成浅黄色沉淀
| Na2S+Cl2=2NaCl+S↓
|
③
| ?
| 2Na+2H2O=2NaOH+H2↑
|
④
| 剧烈反应,迅速产生无色气体
| Mg+2HCl=MgCl2+H2↑
|
⑤
| 反应不十分剧烈,产生无色气体
| 2Al+6HCl=2AlCl3+3H2↑
|
⑥
| 开始时生成白色胶状沉淀,继而沉淀消失
| AlCl3+3NaOH=Al(OH)3↓+3NaCl
Al(OH)3+NaOH=NaAlO2+2H2O
|
(4)实验结论:?。
(5)请用原子结构的知识简单解释上述结论:?。
参考答案:(每空2分,共6分)
(1)实验目的:探究同周期元素性质的递变规律
(2)实验用品:仪器:试管
(3)实验内容:
实验现象:浮在水面上,熔成小球,有气体放出,做不定向移动,随之消失,溶液变成红色
化学方程式:Mg+2H2O Mg(OH) 2+2H2↑
Mg(OH) 2+2H2↑
(4)实验结论:同周期元素随原子序数的递增,失电子能力逐渐减弱,得电子能力增减增强。
(5)请用原子结构的知识简单解释上述结论::同周期元素的原子电子层数相等,核电荷数逐渐减小,原子核对核外电子的吸引能力逐渐增强,电子能力逐渐减弱,得电子能力增减增强。
本题解析:(1)根据实验步骤和原理可知,实验目的是探究同周期元素性质的递变规律。
(2)根据实验步骤可知,实验需要试管。
(3)①镁是活泼的金属,在加热的条件下能和沸水反应生成氢气和氢氧化镁,方程式为Mg+2H2O Mg(OH) 2+2H2↑。
Mg(OH) 2+2H2↑。
③钠是活泼的金属,极易和水反应生成氢气和氢氧化钠,所以实验现象是浮在水面上,熔成小球,有气体放出,做不定向移动,随之消失,溶液变成红色。
(4)根据实验现象可知,结论应该是同周期元素随原子序数的递增,失电子能力逐渐减弱,得电子能力增减增强。
(5)由于同周期元素的原子电子层数相等,核电荷数逐渐减小,原子核对核外电子的吸引能力逐渐增强,失去电子的能力逐渐减弱,得电子能力增减增强,所以金属性逐渐减弱,非金属性逐渐增强。
本题难度:一般
2、填空题 糖类、蛋白质是基本的营养物质,在我们的生活中扮演着及其重要的角色.如何识别这些物质的真伪,既可以检验同学们将化学知识与实际相结合的能力水平,又可以减少伪劣物品对我们生活质量的负面影响.请根据下列的实验现象填写下表:
①烧焦羽毛味;②蓝色;③银镜(析出银);④砖红色沉淀;⑤黄色
| 被鉴别的物质 | 鉴别物质(或鉴别方法) | 现象(填入序号即可)
葡萄糖
新制氢氧化铜
______
淀粉
碘水
______
蛋白质
浓硝酸
______
蛋白质
燃烧
______
葡萄糖
银氨溶液
______
参考答案:葡萄糖是多羟基醛,和新制氢氧化铜反应生成砖红色沉淀,故选④;
淀粉遇碘单质变蓝是碘单质的特性,故选②;
蛋白质与浓硝酸变黄,故选⑤
蛋白质燃烧有烧焦羽毛味,故选①;
葡萄糖和银氨溶液加热反应析出银,发生银镜现象,故选③,
故答案为:④;②;⑤;①;③.
本题解析:
本题难度:一般
3、简答题 某同学想通过下图装置(夹持装置已略去)实验,探究SO2与Na2O2反应的产物.
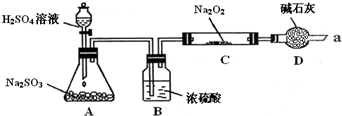
Ⅰ.装置D的作用______.
Ⅱ.如何检验反应中是否有O2生成______.
Ⅲ.对C中固体产物提出如下假设:
假设1:只有Na2SO3
假设2:只有Na2SO4
(1)装置C中,假设2的反应方程式为______.
(2)乙同针对以上两个假设,提出了两个实验方案方案
①在Na2O2反应完全后,为进行如上图实验:
C中的固体配成溶液加Ba(NO3)2溶液沉淀不溶解白色沉淀加足量稀HNO3得出结论:产物是Na2SO4.该方案是否合理______?(填“是”或“否”),理由是______.
方案②在反应进行一段时间后,取少量C中固体放入BaCl2溶液中,充分反应后再加入足量稀盐酸,如果溶液中出现白色沉淀,可得出结论,产物是Na2SO4,假设2成立,此方案是否合理______(填”是”或”否”)理由是______.
参考答案:I.二氧化硫有毒,不能直接排空,二氧化硫是酸性氧化物能和碱性物质反应,所以用碱石灰吸收二氧化硫防止污染空气.
故答案为:吸收二氧化硫尾气,防止污染;
II.氧气的检验方法是:将带火星的木条靠近管口a,若木条复燃,说明有氧气生成,否则没有.
故答案为:将带火星的木条靠近管口a,若木条复燃,说明有氧气生成.
III.(1)过氧化钠有强氧化性,二氧化硫有还原性,所以过氧化钠和二氧化硫能发生氧化还原反应生成硫酸钠.
故答案为:Na2O2+SO2=Na2SO4.
(2)①亚硫酸钠和氯化钡反应生成亚硫酸钡,硝酸有强氧化性,能把亚硫酸钡氧化生成硫酸钡,干扰了亚硫酸根离子的检验,所以该方案不合理.
故答案为:否,稀硝酸能将生成的BaSO3?氧化为BaSO4而使沉淀不溶于稀硝酸.
②若固体C中剩余Na2O2,产物为Na2SO3时,将固体C溶于BaCl2溶液时,Na2O2与水反应产生的氧气能将Na2SO3氧化为Na2SO4,而产生不溶于盐酸的BaSO4白色沉淀,干扰亚硫酸钠的检验,所以该方案不合理.
故答案为:否,若固体C中剩余Na2O2,产物为Na2SO3时,将固体C溶于BaCl2溶液时,Na2O2与水反应产生的氧气能将Na2SO3氧化为Na2SO4,而产生不溶于盐酸的BaSO4白色沉淀.
本题解析:
本题难度:一般
4、实验题 课本中介绍了乙醇氧化的实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约2 mL乙醇的试管里,反复操作几次。注意闻生成物的气味,并观察铜丝表面的变化。
(1)实验室可用化学方法替代“闻生成物的气味”,写出该化学方法的化学反应方程式__________________________________________________。
(2)某同学在探究“闻生成物的气味”的替代方法时,偶然发现向溴水中加入乙醛溶液,溴水褪色。该同学为解释上述现象,提出两种猜想:①溴水将乙醛氧化为乙酸;②溴水与乙醛发生加成反应。请你设计一个简单的实验,探究哪一种猜想正确_________________?
参考答案:(1)CH3CHO+2Ag(NH3)2OH  CH3COONH4+2Ag↓+H2O+3NH3 CH3COONH4+2Ag↓+H2O+3NH3
(2)检测溴水与褪色后溶液的酸、碱性,若酸性明显增强,则猜想①正确,反之猜想②正确。
本题解析:
本题难度:一般
5、填空题 (16分)I.下面a~e是中学化学实验中常见的几种定量仪器:
a.量筒? b.容量瓶? c.滴定管? d.托盘天平? e.温度计
①使用容量瓶的第一步操作是___________________________________。
②若用上述仪器配制500mL 2mol·L-1的NaCl溶液,还缺少的玻璃仪器是_________。
③若用上述仪器测定中和热,则缺少的玻璃仪器为烧杯、__________。
④若用上述仪器进行中和滴定,则缺少的仪器是__________。
Ⅱ某化学兴趣小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体和胆矾晶体,以探索工业废料的再利用。其实验方案如下:

试回答下列问题: &s.5*u.c.om
(1)用的器材已有:滤纸、铁架台、铁圈和烧杯,还要补充的玻璃仪器是
?。
(2)由滤液A制得AlCl3溶液有途径Ⅰ和Ⅱ两条,你认为合理的是?,理由是
? ?。 ?。
(3)从滤液E中得到绿矾晶体的实验操作是?。
(4)写出用滤渣F制备胆矾晶体的有关化学方程式?
?。
(5)有同学提出可将方案中最初溶解合金的烧碱改用盐酸,重新设计方案,也能制得三种物质,你认为后者的方案是否更合理?,理由是?
?。
参考答案:
Ⅰ①检查容量瓶是否漏水 (1分)?②玻棒、胶头滴管? (1分)
③环形玻璃搅拌棒 (1分)?④锥形瓶、滴定管夹(1分)
Ⅱ(1)漏斗、玻璃棒。(2分)
(2)途径Ⅱ更合理;(1分)因为滤液A是NaAlO2溶液,按途径I直接向A加入盐酸得到的AlCl3溶液中含有大量的NaCl杂质;按途径II,通入c(CO2)气体,得D[Al(OH)3]沉淀,将Al(OH)3溶解于盐酸中得到的是纯净的AlCl3溶液。所以途径II更合理。(2分)
(3)蒸发浓缩、冷却结晶。(2分)
(4)2Cu? + O2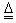 2CuO (1分)? CuO? + H2SO4 = CuSO4? + H2O,(1分) 2CuO (1分)? CuO? + H2SO4 = CuSO4? + H2O,(1分)
CuSO4 + 5H2O = CuSO4·5H2O (1分)
(5)后者的方案不合理。因为该方案不符合实验方案设计的简约性原则,即操作步骤多、消耗试剂量更大、时间长。(2分)
本题解析:略
本题难度:一般
|