微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 10℃时加热饱和NaHCO3溶液,测得该溶液的pH发生如表所示的变化。
温度/℃
| 10
| 20
| 30
| 加热煮沸后冷却到50℃
|
pH
| 8.3
| 8.4
| 8.5
| 8.8
|
?
甲同学认为,该溶液pH增大的原因是HCO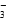 的水解程度增大,故碱性增强,有关反应的离子方程式为__________________________。乙同学认为,溶液pH增大的原因是NaHCO3受热分解生成了Na2CO3,并推断Na2CO3的水解程度________(填“大于”或“小于”)NaHCO3的水解程度,该分解反应的化学方程式为______________________________。
的水解程度增大,故碱性增强,有关反应的离子方程式为__________________________。乙同学认为,溶液pH增大的原因是NaHCO3受热分解生成了Na2CO3,并推断Na2CO3的水解程度________(填“大于”或“小于”)NaHCO3的水解程度,该分解反应的化学方程式为______________________________。
丙同学认为,甲、乙的判断都不充分,他进行如下探究来验证他们的判断是否正确。
(1)在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则________(填“甲”或“乙”)的判断正确,试剂X是________(填序号)。
A.Ba(OH)2溶液? B.BaCl2溶液
C.NaOH溶液? D.澄清石灰水
(2)将加热后的溶液冷却到10℃,若溶液的pH________(填“大于”“小于”或“等于”)8.3,则________(填“甲”或“乙”)的判断正确。
(3)丙同学查阅资料后发现,NaHCO3的分解温度为150℃,他断言________(填“甲”或“乙”)的判断是错误的,原因是________________________________________________。
参考答案:HCO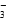 +H2O
+H2O H2CO3+OH- 大于
H2CO3+OH- 大于
2NaHCO3 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
(1)乙 B
(2)等于 甲 (或 大于 乙)
(3)乙 水溶液煮沸时才100℃,达不到NaHCO3的分解温度,所以NaHCO3不分解
本题解析:(1)若乙同学正确,则加入BaCl2溶液会产生白色沉淀。
(2)再冷却到10℃时如果NaHCO3未分解,则pH还应是8.3,甲正确,若pH>8.3,则说明NaHCO3分解成Na2CO3,乙正确。
(3)NaHCO3的分解温度为150℃,而在水溶液中煮沸时温度为100℃,达不到NaHCO3的分解温度,所以乙错误。
本题难度:一般
2、选择题 在25℃下,将a mol·L-1的CH3COONa与0.02 mol·L-1的盐酸等体积充分混合,反应后测得溶液pH=7,则:
(1)a?0.02(填“<”、“>”或“=”);
(2)c(CH3COO-)+ c(CH3COOH)=?mol·L-1,c(CH3COOH)=?mol·L-1;
(3)CH3COOH的电离平衡常数Ka=?(用含a的代数式表达)。
(4)反应后溶液中各种离子浓度由大到小顺序是?
参考答案:
(1)>;(2)0.5a,0.01;(3)(5a-0.1)×10-6;
(4)c(Na+)> c(CH3COO-)> c(Cl-)> c(H+)=c(OH-)(每空2分)
本题解析:(1)若两者刚好反应,生成氯化钠和醋酸,显酸性,要中性,醋酸钠要过量,故)a >0.02;
(2)等体积混合和,溶液体积为原来的2倍,根据物料守恒可得c(CH3COO-)+ c(CH3COOH)= 0.5a?mol·L-1,根据电荷守恒:c(Na+)+ c(H+)=c(CH3COO-)+c(Cl-)+ c(OH-),已知c(Na+)=0.5a,c(Cl-)=0.01,c(H+) =c(OH-),所以c(CH3COOH)=0.01mol·L-1;(3)CH3COOH的电离平衡常数Ka= c(CH3COO-)· c(H+)/(CH3COOH)=(5a-0.1)×10-6;(4)反应后溶液中各种离子浓度由大到小顺序是c(Na+)> c(CH3COO-)> c(Cl-)> c(H+)=c(OH-)
本题难度:简单
3、选择题 25°C时,在浓度为1 mol·L-1的(NH4)2SO4 (NH4)2CO3 (NH4)2Fe(SO4)2的溶液中,测得c(NH4+)分别为a、b、c (单位为mol·L-1),下列判断正确的是?
A.a=b=c
B.a>b>c
C.c>a>b
D.a>c>b
参考答案:C
本题解析:三种溶液中均存在下述水解平衡:NH4++H2O NH3?H2O+H+,溶液显酸性。加入与原水解离子的水解性质相同的,对原水解离子有抑制作用;加入与原水解离子的水解性质相反的,对原水解离子有促进作用。
NH3?H2O+H+,溶液显酸性。加入与原水解离子的水解性质相同的,对原水解离子有抑制作用;加入与原水解离子的水解性质相反的,对原水解离子有促进作用。
对于(NH4+)2CO3,因为CO32-+ H2O HCO3-+OH-,即水解显碱性,促进NH4+水解;对于(NH4+)2Fe(SO4)2,因为Fe2++2H2O
HCO3-+OH-,即水解显碱性,促进NH4+水解;对于(NH4+)2Fe(SO4)2,因为Fe2++2H2O Fe(OH)2+2H+,即水解显酸性,因增大了c(H+),抑制NH4+水解,所以c>a>b,答案选C。
Fe(OH)2+2H+,即水解显酸性,因增大了c(H+),抑制NH4+水解,所以c>a>b,答案选C。
本题难度:一般
4、选择题 下列关于盐类水解反应说法正确的是
A.任何盐都可发生水解反应
B.盐只能发生水解反应而不能发生其他反应
C.盐水解反应肯定能破坏水的电离平衡且促进水的电离
D.盐的水溶液为中性时,则盐一定不发生水解反应
参考答案:C
本题解析:
正确答案:C
A.不正确,由弱酸或弱碱形成的盐才可发生水解反应
B.不正确,水解只是某些盐的性质;
C.正确;盐水解反应肯定能破坏水的电离平衡且促进水的电离?
D.不正确,盐的水溶液为中性时,有两种可能,一是强酸强碱盐不发生水解反应,二是弱酸弱碱盐,水解能力差不多。
本题难度:简单
5、选择题 0.1mol/LNaOH溶液和0.1mol/LNH4Cl溶液等体积混合后,溶液中离子浓度大小顺序正确的是
A.c(Na+)>c(Cl-)>c(OH-)>c(H+)
B.c(Na+)=c(Cl-)>c(H+)>c(OH-)
C.c(Cl-)>c(Na+)>c(OH-)>c(H+)
D.c(Na+)=c(Cl-)>c(OH-)>c(H+)
参考答案:D
本题解析:根据题意可知,二者恰好反应生成氨水和氯化钠,氯化钠是强电解质,氨水是弱碱,存在电离平衡,溶液显碱性,所以正确的答案选D。
点评:本题主要考查浓度相同的强弱电解质在溶液中离子浓度大小的比较。
本题难度:一般