微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (14分)三种短周期元素x、y、z对应的单质X、Y、Z,常温常压下均为无色气体,在适当条件下单质X、Y、Z之间可以发生如右图所示的变化。已知B分子组成中z原子个数比C分子中少一个。
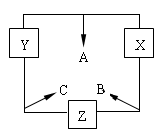
请回答下列问题:
(1)元素x的原子结构示意图?;元素y在周期表中的位置是?;
(2)已知C的浓溶液与浓盐酸相遇可产生白烟,写出白烟成分的电子式:
?。
(3)C与X在一定条件下生成化合物A的化学方程式:?。
(4)一定条件下,A与C反应可生成Y和B,请写出该反应的化学方程式;并用单线桥法标出电子转移的方向与数目。
?。
(5)用电子式表示B的形成过程?。
参考答案: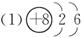 ?;第二周期?第VA族?(2)?
?;第二周期?第VA族?(2)?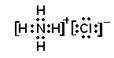
(3)4NH3+5O2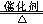 4NO+6H2O?
4NO+6H2O?
(4)4NH3+6NO=5N2+6H2O?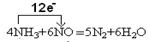 ?(方程式2分,单线桥分析2分)
?(方程式2分,单线桥分析2分)
(5)
本题解析:C的浓溶液与浓盐酸相遇可产生白烟,说明C是氨气。因此Z是氢原子,Y是氮原子。B分子组成中z原子个数比C分子中少一个,所以B是水,X是氧。氨气和氯化氢反应生成氯化铵,属于离子化合物,电子式为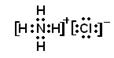 。氨气具有还原性,能被氧气氧化生成NO和水。NO中N原子的化合价是+2价,氨气中N原子的化合价是-3价,二者发生氧化还原反应生成氮气和水,其中氨气是还原剂,NO是氧化剂。水是由极性键形成的共价化合物。
。氨气具有还原性,能被氧气氧化生成NO和水。NO中N原子的化合价是+2价,氨气中N原子的化合价是-3价,二者发生氧化还原反应生成氮气和水,其中氨气是还原剂,NO是氧化剂。水是由极性键形成的共价化合物。
本题难度:一般
2、推断题 气体A只含有X、Y两种短周期元素,X的原子序数大于Y的原子序数。B、D、E是中学化学中的常见气体,各物质间有如下图所示的转化关系
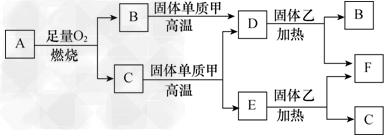
试回答下列问题:
(1)若气体A中,X、Y两元素的质量比等于3∶1,请写出下列物质的化学式:
A__________,B__________,D__________,F__________,乙__________。
(2)若X、Y两元素的质量比在数值上等于X的相对原子质量,且气体A的分子为直线形结构,则A的电子式为________。
(3)C与固体甲在高温时发生反应的化学方程式为___________________________。
参考答案:(1)CH4;CO2;CO;Cu;CuO
(2)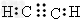
(3)H2O+C CO+H2
CO+H2
本题解析:
本题难度:一般
3、填空题 已知:(1)A是XY型氧化物,它是黑色粉末;(2)将A和稀硫酸共热,得溶液B,向B中滴入适量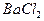 溶液,生成白色沉淀,过滤后得滤液C;(3)将C分成两份,在一份中加入烧碱溶液,可得蓝色絮状沉淀D;(4)往另一份C中放入一枚新铁钉,有单质E析出。已知A、B、C、D、E相互关系如图所示。
溶液,生成白色沉淀,过滤后得滤液C;(3)将C分成两份,在一份中加入烧碱溶液,可得蓝色絮状沉淀D;(4)往另一份C中放入一枚新铁钉,有单质E析出。已知A、B、C、D、E相互关系如图所示。
(1)写出A、B、C、D、E各物质的化学式:A__________,B__________,C__________,D__________,E__________。
(2)请写出上述反应中离子方程式。
? ?;
? ?;
参考答案:3Fe+2O2 Fe3O4? H2O
Fe3O4? H2O H2↑+O2↑
H2↑+O2↑
Fe+2HCl=FeCl2+H2? HCl+AgNO3=AgCl↓+HNO3
本题解析:略
本题难度:简单
4、推断题 在下列各变化中,E为常温下无色无味的液体,F为淡黄色粉末,G为常见的无色气体(反应条件均已省略)。

回答下列问题:
(1)写出H的电子式:_______________。
(2)若反应①在加热条件下进行,A为单质,C为无色有刺激性气味的气体,D为无色无味的气体,且C、D两种气体均能使澄清的石灰水变浑浊,则反应①的化学方程式是 ___________。
①实验需要检验出C、D、E三种气体产物,三种气体检验的先后顺序是 ___________(用化学式填空),在检验D气体前,需除去C气体,所用试剂是_____________ ,反应的离子方程式是_____________ 。
②已知:A(s)+O2(g) =AO2(g) △H=-393.5kJ·mol-1; 2A(s)+O2(g) =2AO(g) △H=-221.0kJ·mol-1,则AO的燃烧热的热化学方程式_________________________。
③AO2在自然界循环时可与碳酸钙反应,碳酸钙是一种难溶物质,它的Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mol/L,则生成沉淀所需CaCl2溶液的最小浓度为___________。
(3)若反应①在溶液中进行,A是一种常见一元强碱,B是一种酸式盐,D是一种气体,且B遇盐酸产生能使品红溶液褪色的气体,在加热条件下,当A过量时,反应①的离子方程式是_______________ 。
(4)若反应①在溶液中进行,A是一种强酸,B是一种含有两种金属元素的盐,且B的水溶液显碱性,A、B均由短周期元素组成,当A过量时,C及D均易溶于水,则A过量时反应①的离子方程式是_________________ 。
参考答案:(1)NaOH
(2)C+2H2SO4(浓)=CO2↑+2SO2↑+2H2O
①H2O、SO2、CO2;酸性KMnO4溶液;2MnO4-+5SO2+H2O=2Mn2++5SO42-+4H+
②CO(g)+ 1/2 O2(g)=CO2(g);△H=-283.0kJ×mol-1?
③5.6×10-5mol/L)
(3)2OH-+NH4++HSO3-=NH3↑+2H2O+SO32-
(4)4H++AlO2-=Al3++2H2O
本题解析:
本题难度:一般
5、填空题 已知
(1)若A为碱性气体,则A→B的化学方程式为______,C→D的化学方程式为______;
(2)若A为空气中含量最多的气体,则A→B的化学方程式为______;
(3)若A为非金属单质,B为导致酸雨的主要气体,则D的浓溶液区别于其稀溶液的特性有:①______性;②______性;
③______性,请用化学方程式举例______.
参考答案:(1)若A为碱性气体,则A为NH3,B为NO,C为NO2,D为HNO3,则A→B的化学方程式为4NH3+5O2催化剂.△ 4NO+6H2O,C→D的化学方程式为3NO2+H2O=2HNO3+NO,
故答案为:4NH3+5O2催化剂.△ 4NO+6H2O;3NO2+H2O=2HNO3+NO;
(2)若A为空气中含量最多的气体,则A为N2,N为NO,则A→B的化学方程式为N2+O2放电.2NO,
故答案为:N2+O2放电.2NO;
(3)若A为非金属单质,B为导致酸雨的主要气体,则A为S,B为SO2,C为SO3,D为H2SO4,浓硫酸区别于其稀硫酸溶液的特性有吸水性、脱水性、强氧化性,如碳与浓硫酸反应,其反应方程式为C+2H2SO4(浓)△.CO2↑+2SO2↑+2H2O,
故答案为:吸水;脱水;强氧化;C+2H2SO4(浓)△.CO2↑+2SO2↑+2H2O.
本题解析:
本题难度:一般