微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
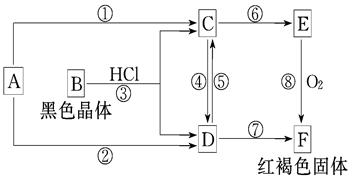
1、填空题 某化学兴趣小组用只含有铝、铁、铜的工业废料制取纯净的氯化铝溶液、绿矾晶体[FeSO4?7H2O]和胆矾晶体,以探索工业废料的再利用.其实验方案如下:
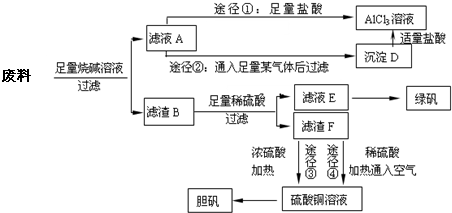
回答下列问题:
(1)写出合金与烧碱溶液反应的离子方程式______.
(2)由滤液A制AlCl3溶液的途径有①和②两种,途径②中通入的某气体其固态可用于人工降雨,则该气体是______(填化学式),滤液A与过量的某气体生成沉淀D的离子方程式为______.你认为较合理的途径是______(填①或②),理由是______.
(3)滤液E若放置在空气中一段时间后,溶液中的阳离子除了Fe2+和H+外,还最可能存在的阳离子是______(用离子符号表示),检测该离子的方法是______.
(4)用滤渣F通过两种途径制取胆矾,与途径③相比,途径④明显具有的两个优点是______、______.
(5)途径③发生的反应中,体现了浓硫酸______性和______性.通过途径④制取胆矾,必须进行的实验操作步骤:加硫酸、加热通氧气、过滤、蒸发浓缩、冷却结晶、______、自然干燥.其中途径④发生的反应为______(用一个离子方程式表示).
参考答案:(1)因铝与碱反应生成偏铝酸钠和氢气,所以化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
则离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)某气体其固态可用于人工降雨,该气体应该为二氧化碳,二氧化碳的固态为干冰,干冰变成气体时须从外界吸收热量,致水蒸气冷凝,能实现人工降雨,AlCl3溶液中通入二氧化碳,碳酸的酸性比氢氧化铝强,所以能反应,且通过量的二氧化碳生成碳酸氢根离子,
故答案为:CO2;AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;途径②;途径①会引入盐酸,氯化钠杂质;
(3)滤液E的成分中的硫酸亚铁中的二价铁离子易被空气中的氧气氧化成三价铁离子,检验三价铁离子的方法是用KSCN溶液,Fe3++3SCN-?Fe(SCN)3血红色,说明E中含有Fe3+,
故答案为:Fe3+;取滤液E少量于试管中,滴入2~3滴?KSCN溶液,若出现血红色,则证明滤液E中含有Fe3+;
(4)途径③的反应:Cu+2H2SO4(浓)?△?.? CuSO4+SO2↑+2H2O
途径④的反应:2Cu+O2+2H2SO4(稀)?△?.? 2CuSO4+2H2O从反应方程式看出产生等量胆矾途径④消耗硫酸少,途径④不会产生污染大气的气体,
故答案为:产生等量胆矾途径④消耗硫酸少;途径④不会产生污染大气的气体;
(5)途径③的反应:Cu+2H2SO4(浓)?△?.? CuSO4+SO2↑+2H2O,从反应方程式看出,硫酸中硫从+6价变为产物中的+4价硫,体现强氧化性,金属和酸反应,生成盐,体现了硫酸的酸性,途径④的反应:2Cu+O2+2H2SO4(稀)?△?.? 2CuSO4+2H2O改成离子反应为2Cu+O2+4H+=2Cu2++2H2O,
故答案为:强氧化、酸;过滤;?2Cu+O2+4H+=2Cu2++2H2O;
本题解析:
本题难度:一般
2、简答题 Ⅰ.下表为元素周期表中短周期的一部分:(用元素符号或化学式填空)
(1)写出元素④在周期表中的位置______.
(2)②、③、⑤的原子半径由大到小的顺序为______.
(3)④、⑤、⑥的气态氢化物的稳定性由强到弱的顺序是______.
(4)①、②、③、⑥中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:______.
Ⅱ.由上述部分元素组成的物质间,在一定条件下,可以发生下图所示的变化,其中A是一种淡黄色固体.请回答:
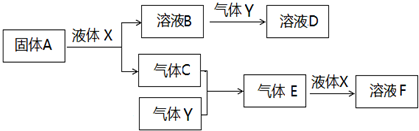
(1)写出固体A与液体X反应的离子方程式______.
(2)气体Y是一种大气污染物,直接排放会形成酸雨.可用溶液B吸收,当B与Y物质的量之比为1:1且恰好完全反应时,所得溶液D的溶质为______(填化学式).
(3)写出气体C与气体Y反应的化学方程式______.
参考答案:Ⅰ.由元素在周期表中的位置可知,①为H、②为O、③为Na、④为Si、⑤为S、⑥为Cl,
(1)元素④处于第三周期第ⅣA族,
故答案为:第三周期第ⅣA族;
(2)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径Na>S>O,
故答案为:Na>S>O;
(3)同周期自左而右非金属性增强,氢化物稳定性增强,即氢化物稳定性HCl>H2S>SiH4,
故答案为:HCl>H2S>SiH4;
(4)H、O、Na、Cl中的某些元素可形成既含离子键又含极性共价键的化合物,由NaOH、NaClO等,电子式为: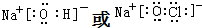 ,
,
故答案为: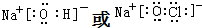 等;
等;
Ⅱ.(1)由上述部分元素组成的物质,A是一种淡黄色固体,则A为Na2O2,能与液态X反应生成气体C与B的溶液,可推知X为H2O、B为NaOH、C为O2,固体A与液体X反应的离子方程式为:2Na2O2+2H2O=4Na++4OH-+O2↑,
故答案为:2Na2O2+2H2O=4Na++4OH-+O2↑;
(2)中气体Y是一种大气污染物,直接排放会形成酸雨,Y为SO2,当naOH与SO2物质的量之比为1:1且恰好完全反应生成D为NaHSO3,
故答案为:NaHSO3;
(3)二氧化硫与氧气在催化剂、加热条件下反应生成三氧化硫,反应方程式为:2SO2+O2 2SO3,
2SO3,
故答案为:2SO2+O2 2SO3.
2SO3.
本题解析:
本题难度:简单
3、简答题 已知A为常见的金属单质,各物质有下图所示的关系:
(1)确定A、B、C、D、E、F的化学式:
A为__________,B为__________,C为__________,
D为__________,E为__________,F为__________。
(2)写出以下反应的化学方程式。
④___________________________________________________________________
⑤___________________________________________________________________
⑧___________________________________________________________________
参考答案:(1)A为Fe,B为Fe3O4,C为FeCl2,
D为FeCl3,E为Fe(OH)2,F为Fe(OH)3。
(2)写出以下反应的化学方程式。
④2FeCl2+ Cl2 = 2FeCl3
⑤Fe+2FeCl3 = 3FeCl2
⑧4Fe(OH)2+O2 +2H2O= 4Fe(OH)3
本题解析:推断题要找准题眼,红褐色沉淀,说明F是氢氧化铁,E在氧气条件下转化为氢氧化铁,说明E是氢氧化亚铁,同时也说明A是铁,B是黑色晶体,与盐酸反应生成亚铁和铁离子,说明B是四氧化三铁,C是氯化亚铁,D是氯化铁。
(1)根据上述的推断,可以确定A为Fe,B为Fe3O4,C为FeCl2,D为FeCl3,E为Fe(OH)2,F为Fe(OH)3。
(2)④是由氯化亚铁转化为氯化铁,一般要加入氧化剂,但是产物只能是氯化铁,则只能加入Cl2。方程式:2FeCl2+ Cl2 = 2FeCl3
⑤是有氯化铁到氯化亚铁,应该加入还原剂,但是不能加铜等,因为产物只有氯化亚铁,则只能选择Fe。方程式:Fe+2FeCl3 = 3FeCl2
⑧氢氧化亚铁在空气中容易转化为氢氧化铁,由白色沉淀迅速转化为灰绿色,最后是红褐色沉淀氢氧化铁,方程式:4Fe(OH)2+O2 +2H2O= 4Fe(OH)3
点评:本题涉及的知识点主要是铁单质及其氧化物,二价铁、三价铁之间的转化。比较简单。
本题难度:一般
4、推断题 下图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物。
已知:①反应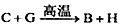 能放出大量的热,该反应曾应用于铁轨的焊接;②I是一种常见的温室气体,它和E可以发生反应:
能放出大量的热,该反应曾应用于铁轨的焊接;②I是一种常见的温室气体,它和E可以发生反应: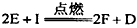 ,F中E元素的质量分数为60%。
,F中E元素的质量分数为60%。
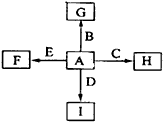
回答问题:
⑴①中反应的化学方程式为____________________;
⑵化合物I的电子式为_______________,它的空间结构是_______________;
⑶1.6gG溶于盐酸,得到的溶液与铜粉完全反应,计算至少所需的铜粉的质量(写出离子方程式和计算过程)_________________;
⑷C与过量NaOH溶液反应的离子方程式为_______________,反应后溶于与过量化合物I反应的离子方程式为_______________________;
⑸E在I中燃烧观察到的现象是_______________。
参考答案:⑴Al+ Fe2O3 Fe+ Al2O3
Fe+ Al2O3
⑵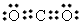 ;直线形
;直线形
⑶2Fe3++Cu=2Fe2++ Cu2+,n(Fe2O3)=0.01mol,依据离子方程式,则n(Cu)= 0.01mol,m(Cu)=0.64g。
⑷2Al + 2OH- + 2H2O==2AlO2- + 3H2↑;AlO2- + CO2 + 2H2O = Al(OH)3↓+ HCO3-
⑸剧烈燃烧,放出热量,生成黑色固体和白色固体
本题解析:
本题难度:一般
5、填空题 (1)从海水中提取镁的主要步骤如下:
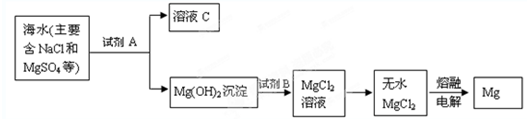
?①上述从海水中提取镁的步骤中,试剂A可以选用______,试剂B选用______.
②分离出Mg(OH)2后的溶液C中除NaCl外,还含有CaCl2、Na2SO4等杂质,为了获得NaCl溶液,在分离后的溶液中依次加入过量的BaCl2溶液、Na2CO3溶液,过滤,再向滤液中加入适量盐酸.写出加入过量BaCl2溶液发生反应的离子方程式是______.
(2)已知A是应用最广泛、用量最大的一种金属单质,B是黑色固体,C是气体单质,在一定条件下有下列转化关系:

①写出A、B的化学式:A______,B______.
②写出A→B、C的化学方程式______.
参考答案:(1)①氯化镁转化为氢氧化镁需要加入碱液,应加入廉价的药品石灰乳或Ca(OH)2,生成氢氧化镁沉淀,过滤后加入盐酸,生成氯化镁,
故答案为:石灰乳或Ca(OH)2;HCl;
②加入过量BaCl2溶液,与硫酸钠反应生成沉淀,反应的方程式为Ba2++SO42-=BaSO4↓,
故答案为:Ba2++SO42-=BaSO4↓;
(2)已知A是应用最广泛、用量最大的一种金属单质,且能与水反应,应为Fe,B是黑色固体,应为Fe3O4,C是气体单质,应为H2,发生反应为3Fe+4H2O??高温?.??Fe3O4+4H2,
①由以上分析可知A为Fe,B为Fe3O4,故答案为:Fe;Fe3O4;
②Fe和H2O反应生成Fe3O4和H2,反应的方程式为3Fe+4H2O??高温?.??Fe3O4+4H2,
答案为:3Fe+4H2O??高温?.??Fe3O4+4H2.
本题解析:
本题难度:一般