微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用水稀释0.lmol·L-1的氨水时,溶液中随着水量的增加而减小的是
A.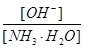
B.
C.[H+]和和[OH-]的乘积
D.OH-的物质的量
参考答案:B
本题解析:氨水中存在如下平衡: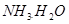 ?
?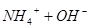 加水稀释,平衡将向右移动,所以A错,根据电离常数只受温度影响,只要温度不变电离常数不变,所以
加水稀释,平衡将向右移动,所以A错,根据电离常数只受温度影响,只要温度不变电离常数不变,所以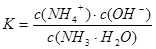 ,则
,则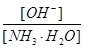
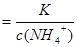
加水稀释,铵根离子浓度减小,比值增大;B正确;C错,[H+]和和[OH-]的乘积为水的离子积常数,只受温度影响;D错,加水稀释,平衡向右移动,氢氧根离子的物质的量增大;
本题难度:一般
2、选择题 寻找新能源是当今世界的一个热点问题,下列能源不属于新能源的是
A.汽油
B.甲醇汽油
C.潮汐能
D.地热
参考答案:A
本题解析:汽油属于石油的分馏产物或裂化产物,仍然是化石燃料,是不可再生的,不是新能源,其余选项都是新能源,答案选A。
点评:新能源是相对于常规能源说的,一般具有资源丰富、可以再生,没有污染或很少污染等。常见的新能源有太阳能、风能、生物质能、氢能、地热能和潮汐能等许多种。
本题难度:简单
3、填空题 (12分)
(1)室温下,在pH=12的某种溶液中,由水电离的c(OH-)为____________。
(2)等体积的下列溶液中,阳离子的总物质的量最大的是____________。
①0.2 mol·L-1的CuSO4溶液
②0.1 mol·L-1的Na2CO3
③0.2 mol·L-1的KCl
④0.1 mol·L-1的Na2SO4
(3)浓度为0.100 mol·L-1的下列各物质的溶液中,c(NH4+)由大到小的顺序是_________________(填序号)。
①NH4Cl?②NH4HSO4?③NH3·H2O?④CH3COONH4
(4)某二元酸(化学式用H2A表示)在水中的电离方程式是:
H2A====H++HA-, HA- H++A2-?。
H++A2-?。
①则Na2A溶液显__________________(填“酸性”“中性”或“碱性”),理由是_______________________________(用离子方程式表示)。
②若有0.1 mol·L-1 Na2A的溶液,其中各种离子浓度由大到小的顺序是:?(填序号)。
A.c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+)
B.c(Na+)>c(OH-)>c(HA-)>c(A2-)>c(H+)
C.c(Na+)>c(H+)>c(A2-)>c(OH-)>c(HA-)
D.c(A2-)>c(Na+)>c(OH-)>c(H+)>c(HA-)
参考答案:(12分)
(1)10-12 mol·L-1或10-2 mol·L-1?(2分)?(2)①?(2分)
(3)②?>①?>④?>③?(2分)
(4)①碱性(1分)? A2-+H2O HA-+OH-?(3分)
HA-+OH-?(3分)
②? A?(2分)
本题解析:(1)pH=12的某种溶液可以是碱溶液,也可以是盐溶液,如果是碱溶液,则水电离的c(OH-)为10-12 mol·L-1,抑制水的电离;如果是盐溶液,则水电离的c(OH-)为10-12 mol·L-1,促进水的电离;
(2)阳离子的总物质的量最大的是①;理由是Cu2++2H2O?Cu(OH)2+2H+;
(3)②最大,因为溶液是显酸性的,抑制NH4+的水解,而CH3COONH4溶液中,CH3COO—促进NH4+的水解;NH4Cl仅仅是本身的水解;NH3·H2O仅仅是电离才有NH4+;
所以c(NH4+)由大到小的顺序:②?>①?>④?>③
(4)Na2A溶液显碱性,理由是:HA- H++A2-?,A2-所对应的酸为HA-,是属于弱酸,所以溶液显碱性;A2-+H2O
H++A2-?,A2-所对应的酸为HA-,是属于弱酸,所以溶液显碱性;A2-+H2O HA-+OH-
HA-+OH-
本题难度:一般
4、填空题 (10分)金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的。难溶金属的氢氧化物在不同pH下的溶解度(s,mol·L-1)见右图。
 ?
?
(1)pH=3时溶液中铜元素的主要存在形式是:________(化学式)
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH为
A.<1? B.4左右? C.>6
(3)在Ni(NO3)2溶液中含有少量的Co2+杂质,___??(能、不能)通过调节溶液pH的方法来除去,理由是_________。
(4)已知一些难溶物的溶度积常数如下表。
物质
| FeS
| MnS
| CuS
| PbS
| HgS
| ZnS
|
Ksp
| 6.3×10-18
| 2.5×10-13
| 1.3×10-36
| 3.4×10-28
| 6.4×10-53
| 1.6×10-24
|
某工业废水中含有Cu2+、Pb2+、Hg2+,最适宜向此工业废水中加入过量的_______除去它们。
A.NaOH? B.FeS? C.Na2S
参考答案:(1)Cu2+
(2)B;
(3)不能;Co2+和Ni2+沉淀的pH范围相差太小
(4) B
本题解析:(1)由图可看出,当pH=3时,Cu(OH)2的溶解度非常大,铜主要以Cu2+的形式存在
(2)若要除去CuCl2溶液中的少量Fe3+,应该调控溶液的pH,使Fe(OH)3的溶解度非常小,同时Cu(OH)2的溶解度非常大或者说Cu2+可以稳定存在,即2.5<pH<4.5范围,故选择B
(3)由于Co2+和Ni2+沉淀的pH范围相差太小,故不能通过调节溶液pH的方法来分离两种离子
(4)由溶度积常数可看出,重金属离子Cu2+、Pb2+、Hg2+的硫化物的溶度积常数远小于FeS的溶度积常数,故可工业废水中加入过量的FeS,发生沉淀的转化,特别重要的时同时析出Fe2+,避免了重金属的污染
本题难度:简单
5、选择题 人体胃液中含有一定浓度的盐酸,若大量喝水,则胃液的pH与所喝入水的体积(V)关系曲线表达正确的是(? )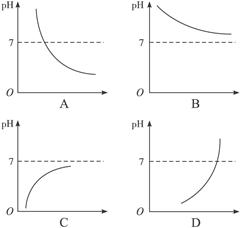
参考答案:C
本题解析:喝入水后盐酸被稀释,c(H+)减小,pH变大。但稀释后仍是酸,故pH<7。
本题难度:一般