|
高考化学知识点整理《化学反应与能量》答题技巧(2017年最新版)(六)
2017-07-10 19:08:21
来源:91考试网
作者:www.91exam.org 【 大 中 小】
参考答案:D
本题解析:A、向CH3COOH溶液中逐步加入CH3COONa固体抑制醋酸的电离,溶液的pH增大,A错误;B、醋酸溶液的导电性越强,氢离子浓度越大,pH越小,则CH3COOH溶液的pHa<b,B错误;C、催化剂能改变活化能,当不能改变焓变,C错误;D、NO2含量到达最低时继续升高温度反而升高,这说明升高温度平衡向正反应方向移动,所以该反应的△H<0,即为放热反应,D正确,答案选D。
考点:考查弱电解质的电离、溶液导电性、焓变以及反应热判断等
本题难度:一般
2、填空题 断开1?mol?H-H键、1?mol?N-H 键、1?mol?N≡N?键分别需要吸收的、能量为436?kJ、391?kJ、946?kJ,求: ?
(1)1?mol?N2生成NH3需____(填“吸收”或“放出”)能量____kJ。 ?
(2)1?mol?H2生成NH3需____(填“吸收”或“放出”)能量____kJ。(不考虑可逆反应)
参考答案:(1)放出;92?
(2)放出;30.67
本题解析:
本题难度:一般
3、选择题 处理含CO、SO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质S和无毒的气体。已知:
①CO(g)+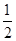 O2(g)=CO2(g)? O2(g)=CO2(g)?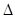 H=-283.0 kJ·mol-1 H=-283.0 kJ·mol-1
②S(g)+ O2(g)=SO2(g)?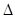 H=-296.0 kJ·mol-1 H=-296.0 kJ·mol-1
下列说法正确的是
A.CO的燃烧热为566.0 kJ·mol-1
B.反应②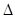 H<0,所以该反应能自发进行 H<0,所以该反应能自发进行
C.使用催化剂能提高其转化率
D.根据①和②推知总反应为2CO(g)+SO2(g)=S(s)+2CO2 (g) △H=-270kJ·mol-1
参考答案:D
本题解析:燃烧热是指在一定条件下,1mol可燃物尾气燃烧生成稳定的氧化物时所放出的热量,所以CO的燃烧热为283.0 kJ·mol-1,A不正确。反应能否自发关键是△G=△H-T·△S<0,所以放热反应不一定是自发的,B不正确。催化剂不能改变平衡状态,所以转化率是不变的,C不正确。根据盖斯定律可知①×2-②得到2CO(g)+SO2(g)=S(s)+2CO2 (g),所以反应热是-283.0 kJ·mol-1×2+296.0 kJ·mol-1=-270kJ·mol-1,D正确。答案选D。
本题难度:简单
4、填空题 (6分)按要求写热化学方程式:
(1)已知稀溶液中,1 mol H2SO4与NaOH溶液恰好完全反应生成正盐时,放出114.6 kJ热量,写出表示H2SO4与NaOH反应的热化学方程式_____________________。
(2)25℃、101 kPa条件下充分燃烧一定量的丁烷气体放出热量为Q kJ,经测定,将生成的CO2通入足量澄清石灰水中产生25 g白色沉淀,写出表示丁烷燃烧热的热化学方程式?。
(3)已知下列热化学方程式:
①CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l)? ΔH1=-870.3 kJ/mol
②C(s)+O2(g)===CO2(g)? ? ΔH2=-393.5 kJ/mol
③H2(g)+O2(g)===H2O(l )?ΔH3=-285.8 kJ/mol
写出由C(s)、H2(g)和O2(g)化合生成CH3COOH(l)的热化学方程式?。
参考答案:(1)H2SO4(aq)+NaOH(aq)===Na2SO4(aq)+H2O(l) ? ΔH=-57.3 kJ/mol(化学计量数、ΔH可成比例变化)
(2)C4H10(g)+O2(g)===4CO2(g)+5H2O(l)?ΔH=-16Q kJ/mol
(3)2C(s)+2H2(g)+O2(g)===CH3COOH(l)?ΔH=-488.3 kJ/mol
本题解析:考查热化学方程式的书写。
(1)中和反应是放热反应,△H小于0,反应式为H2SO4(aq)+NaOH(aq)===Na2SO4(aq)+H2O(l) ? ΔH=-57.3 kJ/mol。
(2)25 g白色沉淀是碳酸钙,其物质的量是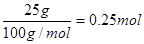 ,根据碳原子守恒可知,生成的CO2是0.25mol,则生成1molCO2放出的热量是4QkJ。燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,所以丁烷燃烧热的热化学方程式为C4H10(g)+O2(g)===4CO2(g)+5H2O(l)?ΔH=-16Q kJ/mol。 ,根据碳原子守恒可知,生成的CO2是0.25mol,则生成1molCO2放出的热量是4QkJ。燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,所以丁烷燃烧热的热化学方程式为C4H10(g)+O2(g)===4CO2(g)+5H2O(l)?ΔH=-16Q kJ/mol。
(3)考查盖斯定律的应用和反应热的计算。将②×2+③×2-①,即得到2C(s)+2H2(g)+O2(g)===CH3COOH(l),所以反应热是-393.5kJ/mol×2-285.8 kJ/mol×2+870.3 kJ/mol=-488.3 kJ/mol。
本题难度:一般
5、选择题 下列变化中,既有共价键和离子键断裂,又有共价键和离子键形成的是
A.2Na2O2+2CO2=2Na2CO3+O2
B.2Na+2H2O=2NaOH+H2↑
C.Cl2+H2O?=?HCl+HclO
D.Na2CO3+BaCl2=BaCO3↓+2NaCl
参考答案:A
本题解析:活泼金属和活泼非金属之间易形成离子键,非金属元素之间易形成共价键(铵盐除外),化学反应的实质是旧化学键的断裂和新化学键的形成,据此分析解答。
A、2Na2O2+2CO2=2Na2CO3+O2,该反应中有离子键、共价键的断裂,也有离子键、共价键的形成,故A正确;B、2Na+2H2O=2NaOH+H2↑,该反应中有金属键、共价键的断裂,有离子键和共价键的形成,没有离子键的断裂,故B错误;C、C12+H2O=HC1+HC1O,该反应中只有共价键的断裂和形成,没有离子键的断裂和形成,故C错误;D、Na2CO3+BaC12=BaCO3↓+2NaC1,该反应中只有离子键的断裂和形成,没有共价键的断裂和形成,故D错误,答案选A。
点评:该题是高考中的常见考点,难度不大。本题以化学反应与化学键的关系的判断为载体,重点考查学生灵活运用基础知识解决实际问题的能力的培养。明确物质中存在化学键的类型是解答本题的关键,注意非金属元素之间易形成共价键,但铵盐除外,铵盐中含有离子键。
本题难度:简单
|