微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 NaCl溶液中含有少量的CaCl2,某学生用过量的Na2CO3使Ca2+离子转化为沉淀而除去,确认Na2CO3已过量的实验方法是______
洗涤沉淀的方法是______.
参考答案:CaCl2和Na2CO3反应生成碳酸钙和氯化钠,Na2CO3已过量则氯化钙无剩余,可以取向反应后的上层溶液少许,再加入Na2CO3溶液,若不产生白色沉淀,则可确认Na2CO3已过量;
沉淀的洗涤方法:向漏斗中加水至浸没沉淀,待水自然流干后,再重复2-3次,
故答案为:沉淀反应后,用试管取出上层清液,再加入Na2CO3溶液,若产生白色沉淀,则可确认Na2CO3已过量;向漏斗中加水至浸没沉淀,待水自然流干后,再重复2-3次.
本题解析:
本题难度:一般
2、选择题 下列叙述正确的是
A.1摩尔氢为2克
B.H2O的摩尔质量为18克
C.44克CO2的体积为22.4L
D.9.8克H2SO4含0.1NA个H2SO4分子
参考答案:D
本题解析:
本题难度:简单
3、实验题 用于分离提纯物质的方法有多种,请根据下列实验要求填空:
(1)分离饱和食盐水和泥沙的混合物,分离方法为?,所用的玻璃仪器有?。
(2)分离相溶的CCl4(沸点76.75℃)和甲苯(沸点110.6℃)的混合物,分离方法为 ?。
(3)从碘水里提取并得到固体碘,应先进行?、?操作,再进行?操作。
参考答案:(每空3分,共18分)(1)过滤,烧杯、漏斗、玻璃棒(答对任意2个得3分,答对任意1个得2分);(2)蒸馏?(3)萃取、分液,蒸发
本题解析:分离提纯物质的方法有多种,如过滤(用于不溶性的固体与液体分离)、蒸馏(分离相溶沸点相差较大的液体混合物)、萃取(一种溶质在互不相溶的溶剂中的溶解度不同,用一种溶剂将溶质从另一种溶剂中提取出来的方法)与分液,⑴用过滤的方法,⑵蒸馏 ,⑶从碘水里提取并得到固体碘,先用CCl4萃取后分液,然后将碘的CCl4溶液加热蒸发即可。
本题难度:一般
4、选择题 下列混合物不能用分液漏斗分离的是
[? ]
A.乙醇和水
B.硝基苯和水
C.溴苯和水
D.四氯化碳和水
参考答案:A
本题解析:
本题难度:简单
5、填空题 为提纯含NaCl和Na2SO4两种杂质的NaNO3溶液,且逐一分离出杂质,某同学设计了如下的实验流程:
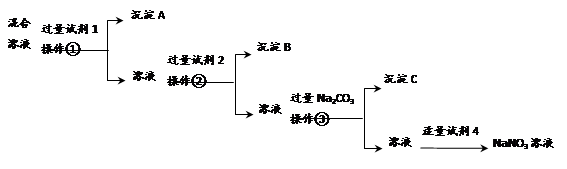
(1)操作①②③的名称都是________(填操作名称)。
(2)写出试剂的名称:试剂1___________;试剂2_____________。
(3)操作③之前加入Na2CO3的目的是________________________。
(4)加入试剂4后,发生反应的离子方程式为_________________。
控制试剂4的加入量“适量”的方法是_____________________。
参考答案:(1)过滤。(2)硝酸钡溶液[Ba(NO3)2];硝酸银溶液(AgNO3)。(3)去除溶液中过量的Ba2+和Ag+。(4)2H++CO32- =H2O+CO2↑(2分)。测定溶液的pH(或加入HNO3后不再产生气泡)。
本题解析:实验室分离含NaCl、Na2SO4和NaNO3的混合物,从而得到较为纯净的NaNO3.实现Cl-、SO42-、和NO3-的相互分离,如先加入AgNO3,则会同时生成Ag2SO4和AgCl沉淀,可在混合物中加入BaCl2或Ba(NO3)2,生成BaSO4沉淀,发生反应为Ba2++SO42-=BaSO4↓,然后加入过量的AgNO3生成AgCl沉淀,反应的离子方程式为Cl-+Ag+=AgCl↓,最后加入过量的Na2CO3,使溶液中的Ag+、Ba2+完全沉淀,过滤之后,加入稀HNO3溶液从而得到NaNO3,最后进行蒸发操作可得固体NaNO3,最后所得溶液为NaNO3和Na2CO3的混合物,加入稀HNO3,硝酸的量不可加入太多,发生:Na2CO3+2HNO3=2NaNO3+H2O+CO2↑,可通过测定溶液PH的方法判断反应是否已经完全,以此解答该题.-、SO42-的性质,把握除杂原则,提纯时不能引入新的杂质,注意把握实验的先后顺序。
本题难度:一般