| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点讲解《键参数——键能、键长与键角》高频试题巩固(2017年最新版)(八)
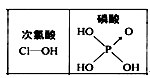 参考答案:C 本题解析:碘单质、四氯化碳、甲烷都是非极性分子,而水是极性分子,所以根据相似相溶原理知,碘易溶于四氯化碳,甲烷难溶于水,满足相似相溶原理,A正确;含有手性碳原子的分子存在手性异构体,选项B正确;化合物的稳定性与化学键强弱有关,氢键影响水的沸点但不影响水的稳定性,故C错误;H3PO4的非羟基氧原子数大于次氯酸的非羟基氧原子数,所以磷酸的酸性大于次氯酸,故D正确,答案选C。 本题难度:一般 2、选择题 下列说法中,正确的是( ) 参考答案:C 本题解析: 本题难度:简单 3、选择题 如图所示是元素周期表的一部分,X、Y、Z、W均为短周期元素,若w原子最外层电子数是其内层电子数的
A.原子半径由大到小排列顺序Z>Y>X B.Y元素的两种同素异形体在常温下都是气体 C.最高价氧化物对应水化物的酸性W>Z D.阴离子半径由大到小排列顺序Z>W>X>Y |
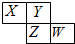
参考答案:X为N元素;Y为O元素;Z为S元素;W是Cl元素.
A、同周期元素的从左到右原子半径逐渐减小,则X>Y,Z>W,同主族元素从上到下原子半径逐渐增大,且原子核外电子层数越多,半径越大,则W>X,所以原子半径大小顺序为Z>W>X>Y,即原子半径Z>X>Y,故A错误;
B、Y为O元素;Y元素的两种同素异形体为氧气和臭氧,在常温下都是气体,故B正确;
C、同周期元素从左到右元素的非金属性逐渐增强,所以非金属性W>Z,元素的非金属性越强,对应最高价氧化物的水化物的酸性越强,所以最高价氧化物对应水化物的酸性:W>Z,故C正确;
D、核外电子排布相同,核电荷数越大,离子半径越小,所以离子半径X>Y,Z>W;最外层电子数相同,电子层越多半径越大,所以W>X,所以阴离子半径由大到小排列顺序Z>W>X>Y,故D正确.
故选:A.
本题解析:
本题难度:一般
4、填空题 下表是部分短周期元素的原子半径及主要化合价:
| 元素代号 | W | R | X | Y | Z | Q | M 原子半径/nm 0.037 0.186 0.074 0.075 0.077 0.110 0.160 主要化合价 +1 +1 -2 -3,+5 +2、+4 -3、+5 +2 |
参考答案:根据化合价可知,W、R为第ⅠA族元素,W可能是H,也可能是Li,如是Li,与X、Y、Z原子半径在同一级数,则在同一周期,同一周期元素原子半径从左到右逐渐减小,而W原子半径最小,则W只能为H元素,R为Na元素,X、Y、Z原子在第二周期,根据化合价,X为第ⅥA族元素,应为O元素,Y、Q为第ⅤA族元素,根据半径大小可知,Y应为N元素,Q为P元素,Z为第ⅣA族元素,应为C元素,M为第ⅡA族元素,应为Mg元素,
(1)七种元素中原子半径最大的元素为Na元素,原子序数为11,原子核外有3个电子层,最外层电子数为1,则在第三周期IA族,M在Z的最高价氧化物中燃烧为Mg在CO2中反应,生成MgO和C,反应方程式为2Mg+CO2?点燃?.?2MgO+C,
故答案案为:第三周期IA族;2Mg+CO2?点燃?.?2MgO+C;
(2)X可与R按1:1的原子个数比形成化合物甲,应为Na2O2,存在离子键和共价键,X可与W组成含18电子的化合物乙,为H2O2,电子式为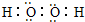
,
故答案为:离子键和共价键;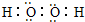
.
本题解析:
本题难度:一般
5、选择题 下列叙述正确的是
[? ]
A.离子化合物中不可能含有共价键
B.共价化合物中不可能含有离子键
C.非极性分子中一定含有非极性键
D.由极性键形成的分子一定是极性分子
参考答案:B
本题解析:
本题难度:简单
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点总结《铁的氧化物.. | |