微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 A、B、C、D、E、F六种元素的原子序数依次递增。
已知:①F的原子序数为25,其余的均为短周期元素;②元素A与元素B同周期,元素A与元素E同主族,且A、B、E三种原子p轨道上均有2个未成对电子;③元素C、D、E在同一周期,且C原子中没有未成对电子。
请回答下列问题:
(1)元素A与元素B的电负性大小比较为:________>________;元素C与元素D的第一电离能的大小比较为:________>________(填入相应的元素符号)
(2)F的核外电子排布式为________。
(3)元素B与元素E形成的晶体所属的晶体类型为________晶体,在该晶体中原子间形成的共价键属于________(从下列选项中选出正确类型)。
A.σ键 B.π键 C.既有σ键,又有π键
(4)由氢元素与A、B两元素共同构成的相对分子质量为30的分子里,中心原子的杂化轨道类型为________,分子的空间构型为________.
(5)根据等电子原理,写出由元素A与元素B构成的一种双原子极性分子的结构式:________。
参考答案:(1)O;C;Mg;Al (2)[Ar]3d54s2(或1s22s22p63s23p63d54s2) (3)原子;A (4)sp2;平面三角形 (5)C≡O
本题解析:A、B是第二周期元素,C、D、E是第三周期元素。由题意,A原子的电子排布式为1s22s22p2,B原子的电子排布式为1s22s22p4;C原子中没有未成对电子,则C原子的电子排布式为1s22s22p63s2,所以A是C(碳),B是O,C是Mg,D是Al,E是Si。(1)电负性O>C。因为Mg原子3s轨道上排满了2个电子,3p轨道上没有电子,Al的3p轨道上有1个电子,所以Mg的第一电离能比Al的第一电离能大。(2)F是25Mn,因为能级交错,E(3d)>E(4s),其核外电子排布式为1s22s22p63s23p63d54s2。(3)SiO2晶体是原子晶体,Si—O键是单键,单键是σ键。(4)该物质是甲醛(HCHO),甲醛是平面三角形结构,C原子以sp2的方式杂化。(5)CO与N2是等电子体,结构相似,CO是极性分子,分子中间的化学键是三键。
本题难度:一般
2、选择题 元素X、Y和Z可结合形成化合物XYZ3;X、Y和Z的原子序数之和为26;Y和Z在同一周期。下列有关推测正确的是
[? ]
A.XYZ3是一种可溶于水的酸,且X与Z可形成共价化合物XZ ?
B.XYZ3是一种微溶于水的盐,且X与Z可形成离子化合物YZ ?
C.XYZ3是一种易溶于水的盐,且Y与Z可形成离子化合物YZ ?
D.XYZ3是一种离子化合物,且Y与Z可形成离子化合物YZ2
参考答案:B
本题解析:
本题难度:简单
3、填空题
(1)画出这两种固体分子的几何构型图:_________。
(2)黄绿色固体溶解度大的原因是:_________。
参考答案:
(1)淡黄色溶解度小的是
 ?
?
黄绿色固体溶解度大的是
 ?
?
(2)因为分子结构不对称,所以分子有极性,因而在水中溶解度大。
本题解析:PtCl2(NH3)2可能的平面正方形结构有:
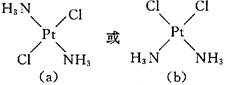 ?
?
a中结构对称,因此分子无极性。由相似相溶原理可知,它在极性分子水中溶解度小,而b的分子有极性,所以水溶性大。
本题难度:一般
4、选择题 正确掌握化学用语是学好化学的基础,下列化学用语正确的是( )
A.乙烯的结构简式为:CH2CH2
B.苯的分子式为:C6H6
C.Cl-的结构示意图为:
D.NaCl的电子式:
参考答案:A.乙烯的结构简式为CH2=CH2,故A错误;
B.苯的分子式为C6H6,故B正确;
C.Cl-的结构示意图为 ,故C错误;
,故C错误;
D.NaCl的电子式为 ,故D错误;
,故D错误;
故选:B.
本题解析:
本题难度:一般
5、选择题 SiCl4的分子结构与CCl4类似,对其作出如下判断:①SiCl4晶体是分子组成的晶体?②常温、常压下SiCl4是液体?③SiCl4的分子是由极性键组成的非极性分子?④SiCl4熔点高于CCl4。其中正确的是(? )
A.只有①②③
B.只有①②
C.只有②③
D.①②③④
参考答案:D
本题解析:CCl4是非极性分子,其晶体是由分子组成的晶体。由于SiCl4的分子结构与CCl4类似,且SiCl4的相对分子质量比CCl4大,故SiCl4晶体是由分子组成的晶体。SiCl4的分子是由极性键形成的非极性分子;SiCl4熔点高于CCl4,常温、常压下SiCl4是液体。
本题难度:简单