微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
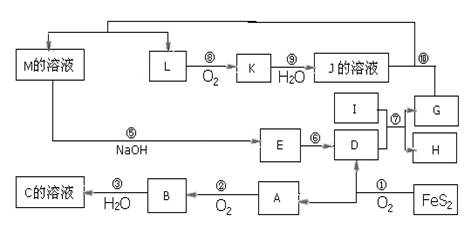
1、推断题 下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出),大部分反应在工业生产中得到实际应用。已知Ⅰ、G是单质,且Ⅰ是一种既能与酸反应又能与碱反应生成氢气的金属,L是一种无色气体,K是一种红棕色气体,E是一种红褐色沉淀。
请填写下列空白:
(1)写出下列物质的化学式:C:?;J:?。
(2)写出下列反应的化学反应方程式:
反应⑦:?。
反应⑩:?。
(3)写工业上NH3与O2在一定条件下制取L的化学方程式:?。
参考答案:(每空2分,共10分,条件未写扣一分)
(1)C:H2SO4?J: HNO3?
(2)反应⑦ :? Fe2O3 ?+ 2Al  ?Al2O3 + 2Fe
?Al2O3 + 2Fe
反应⑩:Fe + 4HNO3 = Fe(NO3)3 +NO↑ +2 H2O
(3)4NH3 + 5O2 4NO + 6H2O
4NO + 6H2O
本题解析:I是既能与强酸反应生成氢气又能与强碱反应生成氢气的金属,判断为Al,K是一种红棕色气体,判断为NO2;D的俗名叫铁红为Fe2O3;,A是形成酸雨的主要气体为SO2,由反应4FeS2+11O2  2Fe2O3+8SO2知A、D为Fe2O3、A为SO2,结合A+O2 →B知,A为SO2,D为Fe2O3,B为SO3,C为H2SO4;I是既能与强酸反应生成氢气又能与强碱反应生成氢气的金属为Al;G、H为Al2O3和Fe中的一种;由K是一种红棕色气体,K为NO2,J为HNO3,L为NO;又由G+HNO3 →M+NO↑分析知G为Fe,H为Al2O3;M应为Fe(NO3)3或Fe(NO3)2;联系反应④:M+H2SO4 →F+NO↑知,M为Fe(NO3)2;F为Fe(NO3)3或Fe2(SO4)3;E应为Fe(OH)3,至此全部物质已确定,分别为:A、SO2;B、SO3;C、H2SO4;D、Fe2O3;E、Fe(OH)3;F、Fe(NO3)3或Fe2(SO4)3;G、Fe;H、Al2O3;I、Al;J、HNO3;K、NO2;L、NO;M、Fe(NO3)2;题目所涉及的问题可顺利解决。
2Fe2O3+8SO2知A、D为Fe2O3、A为SO2,结合A+O2 →B知,A为SO2,D为Fe2O3,B为SO3,C为H2SO4;I是既能与强酸反应生成氢气又能与强碱反应生成氢气的金属为Al;G、H为Al2O3和Fe中的一种;由K是一种红棕色气体,K为NO2,J为HNO3,L为NO;又由G+HNO3 →M+NO↑分析知G为Fe,H为Al2O3;M应为Fe(NO3)3或Fe(NO3)2;联系反应④:M+H2SO4 →F+NO↑知,M为Fe(NO3)2;F为Fe(NO3)3或Fe2(SO4)3;E应为Fe(OH)3,至此全部物质已确定,分别为:A、SO2;B、SO3;C、H2SO4;D、Fe2O3;E、Fe(OH)3;F、Fe(NO3)3或Fe2(SO4)3;G、Fe;H、Al2O3;I、Al;J、HNO3;K、NO2;L、NO;M、Fe(NO3)2;题目所涉及的问题可顺利解决。
(1)依据题干条件和推断,A是酸雨主要成分为:SO2,A+O2→B,B+H2O→C,推知C为H2SO4;D为铁红Fe2O3,E为Fe(OH)3,J为HNO3。
(2)反应⑦的化学方程式为铝热反应,化学方程式为:Fe2O3+2Al Al2O3+2Fe。
Al2O3+2Fe。
反应⑩的方程式为:Fe + 4HNO3 = Fe(NO3)3 +NO↑ +2 H2O。
(3)根据教材知识书写其方程式为4NH3 + 5O2 4NO + 6H2O。
4NO + 6H2O。
点评:本题考查了无机化合物的性质转化关系和性质应用,主要利用特征现象进行分析推断各物质,抓住题眼①和题干信息,结合反应和转化关系判断出各物质是解题关键。
本题难度:一般
2、简答题 已知A是一种有机溶剂,F是一种黄色粉末,N有磁性;B、F、L、O、P是中学化学常见单质;J的相对分子质量比D大16;A和B反应前后气体体积(常温常压)保持不变;在试管中灼烧固体I,试管底部无固体残留;反应①②③均是化工生产中的重要反应.
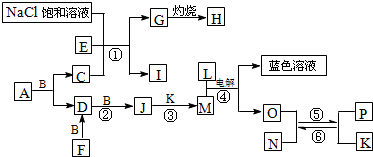
(1)C的电子式为______.
(2)A与B反应的化学方程式为______.
(3)反应①的化学方程式为______.
(4)反应④的离子方程式为______.
(5)高温下由反应⑤生成6molP时共转移______mol电子.
参考答案:已知A是一种有机溶剂,F是一种黄色粉末结合转化关系推断为S,N有磁性判断为Fe3O4;B、F、L、O、P是中学化学常见单质;A和B反应前后气体体积(常温常压)保持不变;在试管中灼烧固体I,试管底部无固体残留推断为NH4Cl;反应①②③均是化工生产中的重要反应,推断反应①是工业侯德榜制碱发生的反应,E,C为NH3,CO2;G为NaHCO3,H为Na2CO3;依据F+B=D,D+B=J,J的相对分子质量比D大16;说明B为O2,D为SO2,J为SO3,推断M为H2SO4,K为H2O,L为单质,L+M(H2SO4)电解得到蓝色溶液,和O,说明L为Cu,M为硫酸,电解得到的溶液是硫酸铜溶液,说明此反应是以铜为电极电解硫酸溶液,生成的O为H2,分析题意结合N有磁性判断为Fe3O4;确定P为Fe,判断结合A是一种有机溶剂含有硫元素,A和B反应前后气体体积(常温常压)保持不变,推断为CS2,C为CO2,E为NH3,综上所述得到:各物质为A为CS2,B为O2,C为CO2,D为SO2,E为NH3,F为S,G为NaHCO3,H为Na2CO3,I为NH4Cl,J为SO3,K为H2O,L为Cu,M为H2SO4,N为Fe3O4,O为H2,P为Fe;
(1)依据分析判断C为CO2,电子式为:
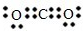
;故答案为:
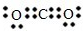
;
(2)A(CS2)与B(O2)反应生成二氧化碳和二氧化硫,反应的化学方程式为:CS2+3O2?点燃?.?CO2+2SO2;
故答案为:CS2+3O2?点燃?.?CO2+2SO2;
(3)反应①是工业侯德榜制碱发生的反应,反应的化学方程式为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl;故答案为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl;
(4)反应④是以铜做电极电解稀硫酸溶液,阳极铜失电子形成铜离子,阴极氢离子得到电子形成氢气 ,反应的离子方程式为:Cu+2H+??电解?.?Cu2++H2↑;
故答案为:Cu+2H+?电解?.?Cu2++H2↑;?
(5)高温下由反应⑤为Fe3O4+4H2?高温?.?3Fe+4H2O,生成6molP为Fe,依据化合价变化计算,反应时共转移电子为16mol,故答案为:16
本题解析:
本题难度:一般
3、填空题 (12分)已知:①A、B、C、D四种物质均含有元素X,可能还含有元素Y或Z。元素Y、X、Z的原子序数依次递增且不超过20。② X在A、B、C、D中的化合价分别为0、-1、+1、+5。③室温下单质A与某种常见一元强碱溶液反应,可得到B和C。④化合物D在二氧化锰催化下受热分解,可制得元素Y的单质。请回答下列问题:
(1)写出B、C、D的化学式:B? __?,C?,D?。
(2)用电子式表示C的形成过程??。
参考答案:(12分)⑴KCl;KClO;KClO3?(2)略
本题解析:略
本题难度:一般
4、简答题 如图转化关系中所有物质均为中学常见物质,且反应中的部分产物已略去.A、F为银白色金属,D、X均为无色无味的气体单质,Z为黄绿色气体单质,其余物质均为化合物.Y为红棕色粉末,常用作红色油漆和涂料.
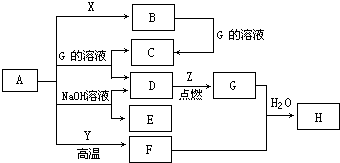
请按要求回答下列问题:
(1)Z的化学式为______.
(2)在实验室中,欲检验H溶液中的金属阳离子,先向溶液中滴加几滴______溶液,再加入几滴氯水,观察到溶液变为______色,证明原溶液中的金属阳离子为______.
(3)B与NaOH溶液反应的离子方程式为______.
(4)A与Y反应生成F的化学方程式为______.
(5)等质量的A分别与足量的G溶液、NaOH溶液充分反应后,相同条件下产生气体D的体积比为______.
参考答案:银白色金属A能与NaOH溶液反应得到E与无色无味的气体单质D,可推知A为Al、E为NaAlO2、D为H2,Z为黄绿色气体单质,则Z为Cl2,Z与D反应得到G为HCl,Y为红棕色粉末,常用作红色油漆和涂料,则Y为Fe2O3,A与Y在高温下反应得到金属单质F为Fe,Fe与G、水反应得到化合物H为FeCl2,Al与G溶液(盐酸)反应得到化合物C为
AlCl3,Al与无色无味气体单质X反应得到B,B溶于盐酸得到C,可推知X为O2、B为Al2O3,
(1)由上述分析可知,Z的化学式为Cl2,故答案为:Cl2;
(2)欲检验FeCl2溶液中的金属阳离子,先向溶液中滴加几滴KSCN溶液,再加入几滴氯水,观察到溶液变为红色,证明原溶液中的金属阳离子为Fe2+,故答案为:KSCN;红;Fe2+;
(3)B为Al2O3,与NaOH溶液反应的离子方程式为:Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O;
(4)A与Y反应生成F的化学方程式为:2Al+Fe2O3高温.Al2O3+2Fe,故答案为:2Al+Fe2O3高温.Al2O3+2Fe;
(5)等质量的Al分别与足量的HCl溶液、NaOH溶液充分反应后,都生成氢气,反应中Al元素化合价都由0价升高为+3价,由于Al完全反应,故转移电子数目相等,故生成氢气的体积相等,即生成氢气体积之比为1:1,故答案为:1:1.
本题解析:
本题难度:一般
5、填空题 (10分)A、B、C、X均为中学化学常见的物质,它们之间有如下转化关系(副产物已略去)。
试回答:
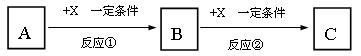
⑴若X是强氧化性单质,则A不可能是_______________。
a.S? b.N2? c.Na? d.Mg? e.Al
⑵若A为强碱溶液,则X可能为________________。
a.AlCl3? b.CO2? c.Al? d.Mg? e.Al2O3
⑶若X是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则B的化学式为____________;C溶液在贮存时应加入少量X,理由是(离子方程式表示)?。
⑷若A、B、C为含有同一金属元素的无机化合物,X为强电解质,A溶液与C溶液能反应生成B,写出该反应的离子方程式?。
参考答案:⑴de?⑵ab?⑶FeCl3;2Fe3++Fe=3Fe2+?⑷Al3++3 AlO2-+6H2O =4Al(OH)3
本题解析:(1)常见的强氧化剂单质有氧气和氯气,由图可推x为O2,选项中的Mg 和Al不能连续与O2反应,故选d、e。
(2)首先排除d项,因为Mg与强碱不反应,其次排除c和e项,因为Al和Al2O3不能与强碱连续反应。只有a和b项符合题给条件,所以选a、b。
(3)在溶液中滴入AgNO3,产生不溶于稀HNO3的白色沉淀,此沉淀为AgCl,由题意与转化关系可推知A为Cl2,x为还原性较强的金属,有所学知识推x为铁单质,则B为FeCl3,C为FeCl2,Fe2+易被氧化,所以FeCl2在贮存时,应加入铁粉来还原Fe3+,离子方程式为:2Fe3++Fe=3Fe2+
(4)x为强电解质,应属于强酸、强碱或者盐类,但根据图所示转化关系确定x只能为强碱。能与强碱连续反应的常见物质就是铝的化合物,所以A含有Al3+,B为Al(OH)3,C含有AlO2-,A溶液与C溶液反应的离子方程式为:Al3++3 AlO2-+6H2O =4Al(OH)3
本题难度:一般