微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列根据反应原理设计的实际应用不正确的是( ? )
A.CO32-+H2O?HCO3-+OH-用热的纯碱溶液清洗油污
B.Al3++3H2O?Al(OH)3(胶体)+3H+:明矾净水
C.Al3++3HCO3-?Al(OH)3↓+3CO2↑:泡沫灭火器灭火
D.SnCl2+H2O?Sn(OH)Cl↓+HCl配制氯化亚锡溶液时加入氢氧化钠溶液
参考答案:D
本题解析:
本题难度:简单
2、选择题 草酸是二元弱酸,草酸氢钾溶液呈酸性。在0.1 mol·L-1 KHC2O4溶液中,下列关系正确的是
[? ]
A.c(K+)+c(H+)=c(HC2O4-)+c(OH-)+c(C2O42-)
B.c(HC2O4-)+c(C2O42-)=0.1 mol·L-1
C.c(C2O42-)>c(H2C2O4)
D.c(K+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-)
参考答案:CD
本题解析:
本题难度:一般
3、选择题 下列有关溶液中相关量的关系描述一定正确的是
[? ]
A.物质的量浓度相等的氨水和NH4Cl溶液等体积混合(设溶液中无氨分子存在):
2c(H+)+ c(NH4+)=c(NH3·H2O)+2c(OH-)
B.pH=2的盐酸和pH=12的Ba(OH)2溶液混合后:pH=7
C.稀盐酸中逐滴加入氨水至pH>7:c(NH4+)> c(Cl-)> c(OH-)> c(H+)
D.0.1mol/L的醋酸的pH=a,0.01mol/L的醋酸的pH=b,则a+1=b
参考答案:A
本题解析:
本题难度:一般
4、填空题 北京奥运会“祥云”火炬燃料是阿烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。
(1)丙烷脱氢可得丙烯已知
C3H8(g)=CH4(g)+HC=CH(g)+H2(g) △H1=156.6 kJ/mol。
CH3CH=CH2(g)=CH4(g)+HC=CH(g) △H2=32.4 kJ/mol。
则相同条件下,反应C3H8(g)=CH3CH=CH2(g) +H2(g)的△H=___________ kJ/mol。
(2)以丙烷为燃料制作的新型燃料电池。电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程程式为__________;放电时,CO32-移向电池的________(填“正”或“负”)极。
(3)碳氢化台物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水.达到平衡时,溶液的pH=
5.60,c(H2CO3)=1.5×10-5 mol/L。若忽略水的电离及H2CO3的第二级电离,则H2CO3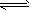 HCO3-+H+的平衡常数K1=__________(已知10-5.60=2.5×10-6)
HCO3-+H+的平衡常数K1=__________(已知10-5.60=2.5×10-6)
(4)常温下,0.1 mol/LNaHCO3溶液的pH大于8,则溶液中c(H2CO3)______c(CO32-) (填“>”、“=”或“<”),原因是____________________(用离子方程式和必要的文字说明)。
参考答案:(1)124.2
(2)C3H8+5O2=3CO2+4H2O;负
(3)4.2×10-7 mol/L
(4))大于;HCO3-+H2O CO32-+H3O+(或HCO3-
CO32-+H3O+(或HCO3-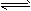 CO32-+H+)、HCO3-+H2O
CO32-+H+)、HCO3-+H2O H2CO3-+OH-、HCO3-的水解程度大于电离程度
H2CO3-+OH-、HCO3-的水解程度大于电离程度
本题解析:
本题难度:一般
5、简答题 (1)向20.00mL稀氨水中逐滴加入等物质的量浓度的盐酸,请回答相关问题:
①当加入10.00mL盐酸时,溶液中各种离子浓度之间的大小关系为(请在括号中填入离子符号):c______>c______>c______>c______
②当盐酸与氨水等物质的量反应时,溶液的pH______7(填“>”或“<”或“=”,下同)
③当溶液pH=7时,反应所消耗的物质(包括还在溶液中存留的物质)之间的关系为:n(NH3?H2O)______n(HCl),溶液中c(?NH4+)______c(Cl-).
(2)已知某弱酸的酸式酸根离子HB-既能发生电离,又能发生水解,请通过实验确定HB-离子是电离程度大还是水解程度大?请简述实验过程和结论.____________.
参考答案:(1)①当加入10.00mL盐酸后,溶液为等物质的量浓度的氨水与氯化铵的混合液,氨水电离使呈碱性,氯化铵水解使溶液呈酸性,等物质的量浓度,电离程度大于水解程度,溶液呈碱性,即:c(?OH-)>c(H+);
?根据电荷守恒有:(NH4+)+c(H+)=c(Cl-)+(?OH-),溶液呈碱性,所以,c(NH4+)>c(Cl-);
水解程度微弱,溶液中c(Cl-)远远大于c(?OH-),
故溶液中各种离子浓度之间的大小关系为c(NH4+)>c(Cl-)>c(?OH-)>c(H+).
故答案为:c(NH4+)>c(Cl-)>c(?OH-)>c(H+)?
②盐酸与氨水恰好反应,为氯化铵溶液,氯化铵是强酸弱碱盐,故溶液呈酸性,即PH<7
故答案为:<
③根据电荷守恒:c(NH4+)+c(H+)=c(Cl-)+c(?OH-),由于溶液pH=7,即c(?OH-)=c(H+),所以c(NH4+)>c(Cl-),溶液中存在平衡?NH4++H2O?NH3?H2O,根据物料守恒有,反应所消耗的物质(包括还在溶液中存留的物质)之间的关系为:n(NH3?H2O)>n(HCl).
故答案为:>;=
(2)用pH试纸测NaHB溶液的pH值,若pH>7,说明HB-水解程度大于其电离程度;若pH=7,说明其水解程度等于其电离程度;如果pH<7,则说明其水解程度小于其电离程度.
故答案为:用pH试纸测NaHB溶液的pH,若pH>7,说明HB-水解程度大于其电离程度;若pH=7,说明其水解程度等于其电离程度;如果pH<7,则说明其水解程度小于其电离程度.
本题解析:
本题难度:一般